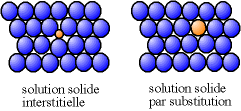Thermodynamique des mélanges/Modèles de mélanges
Les systèmes réels sont souvent complexes à décrire et les physiciens simplifient le problème à résoudre en faisant des modèles qui tentent de représenter la réalité avec plus ou moins de précision.
Le modèle du gaz parfait
[modifier | modifier le wikicode]Les molécules d'un gaz parfait n'ont pas d'interactions entre elles et sont des objets ponctuels (sans volume).
Comme les molécules des gaz parfaits sont sans interactions (EXY = 0), alors il n'y aura pas d'effet thermique lors du mélange ( Qp = ΔHmél = 0 ) et il n'y aura pas d’attraction ou de répulsion entre les molécules A et B ( V = VA (pur) + VA (pur) ou ΔVmél = 0 ).
Pour un gaz parfait i , le potentiel chimique μi s'écrit:
On modifie cette relation en introduisant la pression totale Ptot:
on pose
et comme
- ,
alors
pour un mélange parfait de gaz parfaits, on aura donc l'enthalpie libre G telle que:
pour les gaz purs (séparés) on a :
donc
On calcule l'entropie de mélange en dérivant:
pour un mélange binaire A-B cela s'écrit:
et en divisant par ntot, on obtient:
|
|
Définition du paramètre d'interaction λ
[modifier | modifier le wikicode]Si on note EAA , EBB et EAB les énergies d'interaction entre deux molécules, alors on définit le paramètre d'interaction λ par:
|
|
Remarque = les énergies d'interaction entre deux molécules sont des grandeurs négatives ( E < 0 ).
- si λ = 0 avec EAA = EBB = EAB = 0 ; alors c’est le modèle du mélange de gaz parfaits.
- si λ = 0 avec EAA = EBB = EAB ≠ 0 et EAB = 0,5(EAA+EBB) ; alors c’est le modèle du mélange idéal.
- si λ < 0 alors |EAB| > 0,5|EAA + EBB| ; alors c’est un cas favorable pour la formation d'un mélange homogène.
- si λ > 0 alors |EAB| < 0,5|EAA + EBB| ; alors c’est un cas défavorable pour la formation du mélange, on pourra donc faire le mélange dans certaines conditions mais on pourra aussi avoir parfois un phénomène de démixtion ( i.e. séparation en deux phases ).
Le modèle du mélange idéal
[modifier | modifier le wikicode]Le mélange idéal est caractérisé par les relations:
- EXY ≠ 0 , λ = 0 , ΔHmél = 0 et
où Δsmél est l'entropie molaire de mélange et xi la fraction molaire de i
Le modèle du mélange régulier et du mélange strictement régulier
[modifier | modifier le wikicode]Le mélange régulier est caractérisé par les relations:
- λ ≠ 0 , ΔHmél ≠ 0 et
où Δsmél est l'entropie molaire de mélange et xi la fraction molaire de i
Le mélange strictement régulier est caractérisé par les relations:
- λ ≠ 0 , ΔHmél = λ.xA.xB et
où Δsmél est l'entropie molaire de mélange et xi la fraction molaire de i
Les mélanges réels
[modifier | modifier le wikicode]Les mélanges réels sont décrits par d'autres relations et l'on a pas en général la symétrie des courbes par rapport à x = 0,5 comme dans le cas des modèles précédents.
Les mélanges solides
[modifier | modifier le wikicode]Un mélange binaire solide homogène peut exister de deux manières:
- mélange solide de substitution
- mélange solide interstitiel
 |
 |
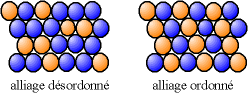
mélange solide de substitution
[modifier | modifier le wikicode]Les 2 solides doivent avoir la même structure cristalline et des rayon atomiques proches. Quand un des constituants est un métal, on parle d' alliages. Une substitution peut conduire, soit à un alliage désordonné, où les différents atomes occupent des positions aléatoires, soit à un alliage ordonné, où les atomes de différentes natures suivent une alternance régulière.
mélange solide interstitiel
[modifier | modifier le wikicode]Ici B doit avoir un rayon assez petit pour se glisser dans le réseau cristallin de A.
démixtion
[modifier | modifier le wikicode]On peut avoir formation de deux phases qui se répartissent dans le solide (cristallites).
Dans le cas des alliages, les phases à forte teneur en éléments d'alliage sont appelés « précipités ».
Les précipités sont souvent des alliages ordonnés, dits « intermétalliques ».
solution solide
[modifier | modifier le wikicode]On parle de solution solide quand un constituant est en excès (par exemple proche de 1).
Références
[modifier | modifier le wikicode]Exercices
[modifier | modifier le wikicode]