Introduction à la science des matériaux/Les constituants de la matière
Résumé
[modifier | modifier le wikicode]Nous présentons ici le modèle de l'atome et les propriétés des matériaux qu’il permet d'expliquer.
Introduction
[modifier | modifier le wikicode]
L'atome est la « brique élémentaire » de la matière. Un matériau est donc composé d'atomes. On dénombre une centaine d'atomes différents, une centaine d'éléments. Comprendre ce qu'est un atome, quelles sont ses propriétés, comment ils s'organisent pour former la matière, nous permettra de comprendre les principales propriétés des différents matériaux.
Découverte de l'atome
[modifier | modifier le wikicode]Depuis l'Antiquité, on se demande si la matière est continue, comme elle semble l'être — un objet ne présente pas de discontinuités ni à la vue, ni au toucher — ou bien si elle est composée de petites particules. On sait maintenant que c’est la deuxième solution.
Un atome fait environ un nanomètre de rayon (1 nm = 10−9 m = un millionième de millimètre) :
- il faut aligner un million (1 000 000) d'atomes côte-à-côte pour former un millimètre ;
- il faut 602 millions de milliards d'atomes d'hydrogène (6,02⋅1014) pour avoir 1 mg.
- Question
- L'atome est trop petit pour être vu ou touché. Quelle preuve pouvez-vous apporter de son existence ?
les arguments ont été présentés dans l'Histoire… :
- le premier argument est un argument « philosophique » : si l’on divise indéfiniment la matière, soit on arrive à une partie indivisible (a-tome, que l’on ne peut couper), soit l’on arrive à du vide, ce qui est difficilement concevable ;
- le second argument est la forme régulière des cristaux naturels (sel, sucre, quartz, gemmes) et la capacité que l’on a à les tailler avec des facettes planes : cela reflète une « organisation interne » régulière, donc une « brique élémentaire » placée de manière régulière ;
- le troisième argument est la chimie : les réactions chimiques se font par proportions entières, les coefficients stœchiométriques des équations chimiques sont des nombres entiers ; on échange donc des quantités définies de matière, ce qui ne serait pas le cas si la matière était continue, si on pouvait la découper en morceaux aussi petit que l’on veut ;
- quatrième argument : si l’on suppose que les gaz sont composés de « particules volantes », alors les calculs sur les relations entre volume, température et pression correspondent à ce que l’on mesure, le modèle est donc pertinent ;
- enfin, on peut arracher des particules à la matière, et la charge électrique enlevée est toujours un multiple d'une charge élémentaire ; on enlève donc des particules entières, les électrons, et non pas des quantités arbitraires.
Cette question est importante : un savoir dont on n'a pas de preuve est une croyance. On risque alors de se laisser berner par une personne charismatique qui présenterait des arguments séduisants, puisque l’on n'a pas soi-même des arguments.
Le phénomène de diffraction des rayons X sur la matière cristalline, connu depuis le début du XXe siècle, montre que les cristaux sont effectivement organisés de manière régulière, donc que l’on a bien une « brique élémentaire ». Cela a été confirmé par les expériences de diffraction des électrons dans les microscopes électroniques en transmission (1931).
On a pu récemment « voir » des atomes :
- on peut arracher les atomes par une décharge électrique sur une aiguille très fine ; l'atome (en fait l'ion) vole alors selon une trajectoire définie, et l’on peut détecter son impact sur un écran ; on peut ainsi arracher les atomes « un par un » et savoir, on calculant la trajectoire, d'où ils viennent ; c’est le principe du microscope à effet de champ inventé en 1951, et de la sonde tomographique atomique inventée en 1967 ;
- le doigt sent une surface lisse car il est trop gros pour sentir les « aspérités » que sont les atomes, il faudrait pouvoir toucher la surface avec une pointe elle-même de la taille d'un atome ; mais une telle pointe est trop fragile, elle ne doit pas toucher la surface ; le microscope à effet tunnel, développé en 1981 par IBM, détecte un courant électrique qui permet de savoir si l’on s'éloigne où si l’on s'approche de la surface, on peut donc ainsi tracer le profil de la surface sans la toucher, avec une résolution (une finesse de l'image) de l’ordre du nanomètre.
Dans les deux cas, l'image que l’on obtient est recomposée par ordinateur.
-
Figure de diffraction par électrons sur un cristal, dans un microscope électronique en transmission
-
Recomposition d'une aiguille par une sonde tomographique atomique ; les petites boules sont des atomes
-
Surface de l'or vue par un microscope à effet tunnel ; les petites boules sont des atomes
Corps pur, corps simple, élément
[modifier | modifier le wikicode]
corps ne pouvant pas être décomposé selon les techniques physiques : décantation (laisser un liquide reposer), filtration, distillation (chauffer un liquide pour l'évaporer)

Un corps pur change d'état à température constante : lorsqu’il fond, bout, se condense et se solidifie, sa température reste fixe.

Les corps purs peuvent en général encore être décomposés par des méthodes classiques. Les corps purs non décomposables sont appelés corps simples.
corps pur ne pouvant pas être décomposé selon les techniques chimiques : précipitation, dissolution (décomposition par un liquide, par exemple l'eau, l'alcool, un acide), pyrolyse (décomposition par la chaleur), électrolyse (décomposition par l'électricité)
plus petite quantité d'un corps simple ; une molécule de corps simple peut se composer de plusieurs atomes identiques
Un atome est toujours électriquement neutre.
L'eau est un corps pur : elle fond et gèle à température constante (0 °C à pression atmosphérique), elle bout et se condense à température constante (100 °C à pression atmosphérique). On peut l'extraire de substances par chauffage modéré (distillation).
Lavoisier a réussi à décomposer l'eau par pyrolyse, en faisant passer la vapeur d'eau sur un fer rouge ; on sait maintenant la décomposer par électrolyse. Il a obtenu deux gaz qu’il n'a pas pu décomposer : le dihydrogène et le dioxygène. Le dihydrogène et le dioxygène sont des corps simples.
La molécule de dihydrogène est composée de deux atomes d'hydrogène (H2), la molécule de dioxygène est composée de deux atomes d'oxygène (O2). La molécule d'eau est composée de deux atomes d'hydrogène et d'un atome d'oxygène (H2O).
La notion de « tous identiques » est à nuancer, notamment avec la notion d'isotope, mais ceci sort du cadre de ce cours. Un élément est donc une « grande famille », et un atome est un membre de cette grande famille.
Représentation et classification des éléments
[modifier | modifier le wikicode]Les éléments sont représentés par un symbole d'une ou deux lettres. Ils sont classés par leur numéro atomique Z (voir ci-dessous), de 1 à 118. Leurs propriétés varient de manière périodique selon le numéro atomique ; on les place dans un tableau, par ordre de Z croissant, selon le sens de lecture romain (de gauche à droite et de haut en bas) :
- les lignes sont appelées « périodes », elles sont numérotées de 1 à 7 ; les propriétés varient de manière continue dans une ligne ;
- les colonnes sont appelées « groupes », numérotés ci-dessous de IA à VIIIA (mais il existe d'autres numérotations) ; les éléments d'un même groupe ont des propriétés proches.
Pour des raisons de place, les éléments de numéro atomique 57 à 71 et 89 à 103 sont placés à part sous le tableau (sinon, le tableau serait trop large).
Pour illustrer la similitude des propriétés dans une colonne :
- le potassium (symbole chimique K, numéro atomique Z = 19) et le sodium (Na, Z = 11) sont dans la colonne IA (1re colonne) ; dans les régimes sans sel, on remplace le chlorure de sodium (sel de table) par du chlorure de potassium, qui possède un pouvoir salant similaire ;
- l’argent (Ag, Z = 47) et l'or (Au, Z = 79) sont tous les deux dans la colonne IB (11e colonne) ; ce sont tous les deux des métaux précieux, mous, inaltérables ;
- le palladium (Pd, Z = 46) et le platine (Pt, Z = 78) sont tous les deux dans la colonne VIIIB (10e colonne) ; sont des métaux précieux utilisés comme catalyseur ;
- le fluor (F, Z = 9), le chlore (Cl, Z = 17), le brome (Br, Z = 35) et l'iode (I, Z = 53) sont tous dans la colonne VIIA (17 e colonne) ; ils constituent la famille des halogènes ;
- la dernière colonne (VIIIA) sont les gaz rares, des gaz monoatomiques ; le néon (Ne, Z = 10), le krypton (Kr, Z = 36) et le xénon (Xe, Z = 54) sont utilisés pour l'éclairage.
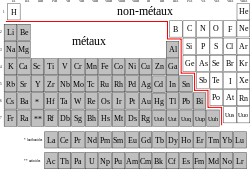
On distingue deux grandes catégories d'éléments : les métaux et les non-métaux. La séparation est une ligne diagonale allant du bore au polonium. L'hydrogène, aux très fortes pressions, cristallise et forme un métal, mais ce phénomène n'ayant pas lieu dans les conditions habituelles sur Terre, il n'est habituellement pas considéré comme un métal.
Il existe d'autres familles d'éléments, mais nous nous contenterons de cela pour l'instant.
Pour fixer les idées sur l'abondance des éléments :
- l’élément le plus répandu dans l’Univers est l’hydrogène (étoiles et hydrogène interstellaire) ;
- l’oxygène et le silicium sont les éléments les plus répandus sur Terre (roches) ;
- le cœur de la Terre, le noyau terrestre, est composé de fer (80 %) et de nickel.
- Règles générales
On énonce classiquement quelques règles générales concernant les éléments. Ces règles ne sont pas vraies pour tous les éléments. Elles sont vraies, avec quelques exceptions :
- pour les deux premières colonnes et les deux dernières colonnes du tableau ;
- pour les trois premières lignes du tableau.
Pour le cœur du tableau, et en particulier pour les métaux dits « de transition » (colonnes 3 à 12), elles comportent de nombreuses exceptions.
Toutefois, ces règles générales permettent de comprendre qualitativement comment se comporte la matière. Par ailleurs, elles sont vraies pour des éléments importants dans les domaines qui nous concernent :
- polymères : C, H, O (constituants principaux des polymères) ;
- métaux : O (constituant des oxydes, intervient pour la réduction du minerai et dans la corrosion) ;
- céramiques : C, N, O (les céramiques sont essentiellement des carbures, des nitrures ou des oxydes).
Lorsque, dans la suite, nous énoncerons une « règle générale », il faudra se souvenir qu'elle comporte de nombreuses exceptions.
- À retenir
Il faut surtout retenir l'organisation générale du tableau (similitude des propriétés par zones, et en particulier par colonne) et le classement par numéro atomique Z (qui est défini ci-dessous). Il faut également connaître les symboles chimiques des principaux éléments :
- Al : aluminium ;
- B : bore ;
- C : carbone ;
- Be : béryllium ;
- Ce : cérium ;
- Co : cobalt ;
- Cr : chrome ;
- Cu : cuivre ;
- Fe : fer ;
- H : hydrogène ;
- Mg : magnésium ;
- Mn : manganèse ;
- Mo : molybdène ;
- N : azote (nitrogen en anglais, cf. nitrate, nitrure, nitrite)
- Nb : niobium ;
- Ni : nickel ;
- O : oxygène ;
- P : phosphore ;
- Pb : plomb ;
- S : soufre ;
- Si : silicium ;
- Sn : étain ;
- Ta : tantale ;
- Ti : titane ;
- U : uranium ;
- V : vanadium ;
- W : tungstène (wolfram en allemand) ;
- Zn : zinc ;
- Zr : zirconium.
- Pour aller plus loin
Constitution de l'atome
[modifier | modifier le wikicode]
L'atome se décompose en :
- un noyau, portant une charge électrique positive, d'un diamètre d'environ 10−15 m (1 fm, 0,001 pm, 0,000 001 nm) ;
- un nuage électronique qui l'entoure, chargé négativement, d'un diamètre d'environ 10−10 m (10 000 fm, 100 pm, 0,1 nm).
Le noyau est donc cent mille fois plus petit que le nuage électronique, mais il est plus de mille fois plus lourd. Donc le noyau représente environ
- 10−15 % du volume de l'atome ;
- 99,9 % de la masse de l'atome ;
un atome est donc composé de 99,999 999 999 999 9 % de vide…
Lorsque l’on parle de « rayon de l'atome », on se réfère au rayon de son nuage électronique. Les atomes ont donc un rayon de quelques nanomètres. On utilise fréquemment l'angström Å pour exprimer le rayon d'un atome :
- 1 Å = 10−10 m = 0,1 nm = 100 pm.
Le rayon atomique va typiquement de 25 pm (0,25 Å) pour l'hydrogène (H) à 195 pm (1,95 Å) pour le lanthane (La) ou l'actinium (Ac).

Le noyau comporte Z charges positives, et le nuage électronique comporte Z charges négatives, Z électrons. Le nombre Z est un entier et est appelé numéro atomique.
L'unité internationale de charge électrique est le coulomb (C) ; c’est la quantité de charge qui transite dans un fil durant une seconde lorsque le courant est de un ampère. La charge élémentaire est appelée e ; c’est une des constantes fondamentales de la physique.
Le noyau porte une charge Z⋅e, et chaque électron a une charge -e.
Les électrons sont regroupés en couches de rayon défini. On peut voir le nuage électronique comme étant composé de plusieurs nuages concentriques, ayant chacun un rayon moyen différent ; une « couche de nuages » comprend plusieurs « nuages-électrons ». En quelque sorte, lorsque l'électron est extrait de l'atome, son nuage se « condense » pour former une petite particule.
Cette vision n’est pas exacte, mais une description plus précise nécessiterait de se lancer dans la physique quantique, ce qui dépasse le cadre de ce cours.
Pour simplifier, on représente souvent une couche électronique comme une orbite, et les électrons comme des particules satellites (représentation de Bohr).
On nomme les couches K (1re couche, couche de cœur, la plus proche du noyau), L (2e couche), M (3e couche), N, …
- la couche K, la plus proche du noyau, peut contenir 2 électrons (e- en abrégé) ;
- la couche L peut contenir 8 e- ;
- couche M : 18 e- ;
- …
- couche n : 2n2 e-.
Plus le numéro atomique est élevé, plus l'atome est lourd. On ne donne pas la masse d'un atome, qui serait un nombre trop petit, mais la masse M d'une mole d'atomes (1 mol en abrégé), c'est-à-dire de atomes, étant le nombre d'Avogadro. M est appelé « masse molaire atomique ».
Une mole de carbone représente une masse de 12 g ; c’est la définition de base du nombre d'Avogadro.
Le tableau ci-dessous indique, en haut à droite de chaque case, la masse molaire atomique M en g/mol pour tous les éléments. Les valeurs entre parenthèse sont celle des éléments que l’on ne trouve pas dans la nature.



- Règles générales
La dernière couche électronique d'un atome contient au plus 8 électrons (à l'exception de la couche K qui ne peut contenir que deux électrons, et du palladium). En conséquence, la dernière couche n'est quasiment jamais remplie (sauf pour l'hélium et le néon), l'avant-dernière couche n’est pas toujours remplie, mais les couches situées en dessous le sont toujours. Notons que :
- le nombre d'électrons sur la dernière couche détermine le comportement chimique de l'atome, c'est-à-dire sa capacité à s'associer à d'autres atomes pour former des molécules, et sa capacité à perdre ou à capturer des électrons (voir ci-après) ;
- dans tableau de classification périodique, tous les éléments d'une même colonne ont le même nombre d'électrons sur leur couche périphérique ; par exemple, le bore (B, Z = 5), l'aluminium (Al, Z = 13) et le gallium (Ga, Z = 31) ont tous trois électrons sur leur dernière couche.
- À retenir
Les règles générales énoncées ci-dessus sont là pour montrer l'importance de la structure des couches électroniques sur les propriétés des atomes. Ces règles ont des exceptions, mais une étude précise fait appel à la physique quantique, ce qui dépasse le cadre de ce cours.
L'important est donc de comprendre que :
- le nombre d'électrons sur la dernière couche détermine en grande partie les propriétés chimiques de l'atome ;
- dans une même colonne du tableau, les atomes ont quasiment tous le même nombre d'électrons sur la dernière couche.
- Pour aller plus loin
Molécules
[modifier | modifier le wikicode]La molécule est donc la plus petite quantité d'un corps pur. Une molécule peut contenir :
- 1 atome : gaz rares He, Ne, Ar, Kr, …
- 2 atomes : dihydrogène H2, dioxygène O2, diazote N2, monoxyde de carbone CO, …
- 3 atomes : eau H2O, dioxyde de carbone CO2 (gaz carbonique), ozone O3, …
- …
- plusieurs centaines ou milliers d’atomes : ADN, polymères.

Les atomes s'assemblent pour former certaines molécules. Deux atomes s'assemblent en mettant en commun un ou plusieurs électrons ; on parle de liaison covalente.
Cette liaison peut être simple, double ou triple :
- liaison simple : un seul électron est mis en commun ;
- liaison double : deux électrons sont mis en commun ; cette liaison est plus rigide et plus courte que la première ;
- liaison triple : trois électrons sont mis en commun, c’est la liaison la plus courte et la plus rigide.
Par exemple, entre deux atomes de carbone C :
- la liaison simple C-C a une longueur de 154 pm (1,54 Å) ;
- la liaison double C=C a une longueur de 134 pm (1,34 Å) ;
- la liaison triple C≡C a une longueur de 120 pm (1,20 Å).
On peut représenter une molécule de plusieurs manières :

- formule chimique
- formule compacte : donne la composition de la molécule, par exemple
une molécule d'acide éthanoïque C2H4O2 (vinaigre) contient :- 2 atomes de carbone,
- 4 atomes d’hydrogène,
- 2 atomes d’oxygène ;
- formule développée : indique organisation de la molécule et type de liaison (- liaison simple, = liaisons double, ≡ liaison triple), voir l'exemple ci-contre ;
- formule semi-développée : indique les groupements fonctionnels, par exemple
acide éthanoïque CH3-COOH, le groupement « -COOH » est la fonction « acide organique ».
- Représentation graphique
Les atomes sont représentés comme des « sphères dures », parfois comme des sphères s'interpénétrant (symbolisant la forme du nuage électronique avec les électrons communs) ; on respecte si possible les rayons relatifs des atomes, on donne des couleurs aux différents éléments, et la molécule est représentée en perspective. On utilise deux représentations :
- la représentation compacte : les atomes sont accolés ;
- la représentation éclatée : les atomes sont écartés, on fait figurer les liaisons.
-
Représentation compacte de l'acide acétique
-
autre représentation compacte
-
représentation éclatée de l'acide acétique
-
autre représentation éclatée
- Valence
La valence est le nombre de liaisons que peut former un atome. Un atome va avoir tendance à se lier afin d’avoir 8 électrons sur sa dernière couche (règle de l'octet) : soit ils « perdent » des électrons en le partageant (colonnes de gauche du tableau périodique), soit ils en « gagnent » en les empruntant (colonnes de droite). La valence est donc étroitement liée au nombre d'électron sur la dernière couche.
Les gaz rares ont une valence nulle, puisque leur dernière couche contient 8 e-, mais on peut former certaines molécules contenant du fluor, le fluor étant l'élément le plus réactif.
- À retenir
Comme précédemment, l'étude de la liaison moléculaire sort du cadre de ce cours. Les éléments ci-dessus sont surtout là pour illustrer le fait que :
- la molécule se constitue par un partage d'électrons entre les atomes deux à deux (à l'exception des liaisons dites « délocalisées ») ;
- la capacité à se lier, la valence, dépend de la colonne du tableau dans laquelle se trouve l'élément, et en particulier du nombre d'électrons sur la couche externe.
Réaction chimique
[modifier | modifier le wikicode]Une réaction chimique est un événement au cours duquel les molécules se transforment, échangent leurs atomes. On a :
- des réactants : ce sont les molécules présentes avant la réaction ;
- des produits de réaction : ce sont les molécules présentes après la fin de réaction.
La réaction est représentée par une équation de réaction ; l'événement est représenté par une flèche :
- réactants → produits de réaction.
Par exemple, la combustion complète du méthane
CH4
dans le dioxygène
O2
s'écrit :
- CH4 + 2 O2 → CO2 + 2 H2O.
On a :
- réactants :
- méthane CH4,
- dioxygène O2 ;
- produits de réaction :
- dioxyde de carbone (gaz carbonique) CO2,
- vapeur d'eau H2O.

Les nombres devant les molécules sont les coefficients stœchiométriques. Ils indiquent le nombre de molécules impliquées dans une étape élémentaire de la réaction chimique :
- pour brûler une molécule de méthane, il faut deux molécules de dioxygène ; on obtient alors une molécule de dioxyde de carbone et deux molécules d'eau.
On voit que le nombre d'atomes de chaque élément est identique de chaque côté de la flèche :
- 1 C ;
- 4 H ;
- 4 O.
La réaction est dite « équilibrée ». Cela traduit la loi de Lavoisier.
Certaines réactions peuvent avoir lieu dans les deux sens, on utilise alors une double flèche ⇌, ou parfois un signe égal =.
Une réaction chimique est donc une modification des liaisons :
- les liaisons concernent les électrons périphériques de l’atome ;
- la réactivité dépend donc des électrons périphériques.
Ions
[modifier | modifier le wikicode]
Un ion est un atome ou une molécule ayant gagné ou perdu des électrons. L'ion n'est donc pas électriquement neutre ; la charge électrique est notée en exposant. On distingue :
- les anions, ou ions négatifs : atome ou molécule ayant gagné un ou plusieurs électrons
p.ex. Cl-, O2- (ou O--), CO32- (ou CO3--) ; - les cations, ou ions positifs : atome ou molécule ayant perdu un ou plusieurs électrons
p.ex. : Na+, Fe2+ (ou Fe++), H3O+
Les électrons concernés sont évidemment les électrons périphériques. Le tableau périodique des ions montre bien que les atomes dans une même colonne, qui ont le même nombre d'électrons dans la couche périphérique, forment en général des ions monoatomiques de même charge.
On voit réapparaître la règle de l'octet (règle générale) :
- lorsqu’il y a 4 e- ou moins dans la couche externe, on ne forme que des cations (départ d'électrons) ; il faut au moins 5 e- pour pouvoir former un anion ;
- les halogènes ne forment que des anions ;
- les gaz rares ne forment pas d'ion.
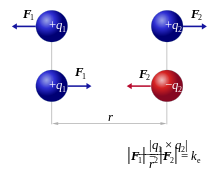
Rappelons que :
- les charges de même signe se repoussent : + et + se repoussent, - et - se repoussent ;
- les charges opposées s'attirent : + et - s'attirent.
La force attractive ou répulsive est la force électrostatique, ou force de Coulomb. Cette force constitue un autre type de liaison chimique.
- À retenir
Comme précédemment, l'étude précise de l'ionisation est hors du cadre du cours. Il faut retenir que :
- en général, les atomes d'une même colonne forment des ions similaires ;
- l'attraction et la répulsion électrostatiques des ions forme la liaison ionique.
Molécule polaire
[modifier | modifier le wikicode]
Une molécule polaire est une situation intermédiaire entre la molécule et l'ion. Certains éléments, en particulier l'oxygène et le fluor, attirent plus les électrons que d'autres. En conséquence, lorsqu’ils forment une liaison covalente, le nuage électronique est plus concentré autour d'eux.

Si la charge de la molécule est nulle, il y a en revanche des charges partielles négatives (δ-) et positives (δ+). Par exemple, dans le cas de l'eau
H2O
, l'atome d'oxygène porte une charge δ- et les atomes d'hydrogène une charge δ+.
Les charges opposées s'attirant, les molécules polaires peuvent créer des liaisons électrostatiques ; cependant, les charges étant incomplètes, ces liaisons sont moins fortes que les liaisons ioniques. On parle de « liaison hydrogène » puisque l'hydrogène porte très souvent une charge δ+.
Potentiel de liaison
[modifier | modifier le wikicode]
Dans une molécule ou un cristal, les atomes sont liés par des liaisons, quelle qu’elles soient (liaison covalente, hydrogène, ionique, …). Les atomes sont donc attirés entre eux. Si l’on veut les séparer, il faut dépenser de l'énergie, donc fournir de l'énergie aux atomes.
Dans le potentiel de liaison, ou énergie de cohésion, on a donc un terme d'attraction : une énergie qui diminue lorsque les atomes se rapprochent, et qui augmente lorsque les atomes s'éloignent. Par convention, on considère que cette énergie est nulle lorsque les atomes sont très éloignés. Dans le cas d'une liaison ionique, cette énergie d'attraction est tout simplement le potentiel coulombien, en -1/r si r est la distance entre les atomes.
À courte distance, les atomes se repoussent : on ne peut pas mettre deux atomes au même endroit. Il faut fournir une pression énorme pour pouvoir fusionner des atomes. C'est un phénomène qui a lieu dans le Soleil, et que l’on essaie de reproduire en laboratoire.
Quoi qu’il en soit, l'énergie de répulsion varie à l'inverse : elle augmente lorsque les atomes se rapprochent, et diminue lorsque les atomes s'éloignent.
Si l’on ajoute les deux termes, on obtient une énergie représentée ci-contre : elle tend vers +∞ quand r tend vers 0 (il faut une « énergie infinie » pour fusionner les atomes), elle présente un minimum négatif, puis tend vers 0 lorsque r tend vers +∞.

Cela permet d'expliquer la distance interatomique : au repos, la distance interatomique r0 est la valeur de r pour laquelle le potentiel est minimal.
Cela permet également d'expliquer l'élasticité. En effet, autour de r0, la courbe du potentiel ressemble à une parabole, à une loi en r2 (développement limité au second ordre). La force dérivant de l'énergie, on a donc une loi linéaire pour la force (voir la loi des ressorts). On peut ainsi retrouver la loi de Hooke.
Par ailleurs, la « profondeur du puits » correspond à l'énergie qu’il faut fournir pour séparer les atomes, c'est-à-dire est proportionnelle à la température de sublimation, et d'une certaine manière à la température de fusion. Et plus le puits est profond, plus la parabole est étroite, donc plus le matériau est rigide. On en conclut que les matériaux qui fondent à basse température sont souples (ont un module de Young faible) et que les matériaux qui fondent à haute température sont rigides (ont un module de Young élevé).
Cette « profondeur du puits » intervient dans le calcul de l'énergie réticulaire, c'est-à-dire l'énergie nécessaire pour décomposer une mole d'un solide cristallisé en ses constituants en phase gazeuse.

Enfin, cette courbe permet d'expliquer la dilatation. En effet, la température correspond à une agitation des atomes ; les atomes oscillent autour de leur position stable. L'énergie cinétique est proportionnelle à la température absolue T (en kelvin).
Or, la courbe du potentiel est dissymétrique : pour une température donnée T, l'intervalle des distances interatomiques se décale vers la droite, l'écartement moyen entre les atomes augmente, la matière se dilate.
Bilan
[modifier | modifier le wikicode]La dernière couche électronique permet de comprendre la manière dont les atomes s'assemblent :
- en partageant des électrons pour former des molécules ;
- en échangeant des électrons pour former des ions.
Nous avons vu trois types de liaisons :
- les liaisons covalentes, moléculaires, par mise en commun d'électrons ;
- les liaisons ioniques, par attraction électrostatique ;
- les liaisons hydrogène, par attraction électrostatique par des charges partielles (résultant de liaisons covalentes polaires).
Les éléments chimiques sont classés dans un tableau en fonction de leur comportement chimique. On peut énoncer des règles générales, qui marchent plutôt bien pour les trois premières lignes du tableau, mais qui comportent des exceptions, en particulier pour les métaux de transition (milieu du tableau). Il faut toutefois retenir que de nombreuses propriétés dépendent du nombre d'électrons sur la couche externe.
Le potentiel de liaison entre les atomes a une forme de puits dissymétrique, ce qui permet d'expliquer :
- la distance interatomique ;
- l'élasticité ;
- la dilatation.
Ressources
[modifier | modifier le wikicode]- Charles et Ray Eames, « Powers of Ten™ », sur Youtube, , en particulier à partir de 5:40.