Protides/Acide aminé
Nature chimique des acides aminés
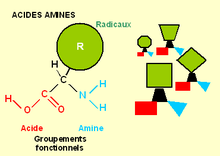
[modifier | modifier le wikicode]Un acide aminé est une molécule organique, possédant donc une chaîne carbonée (ou squelette carboné), montrant un groupement fonctionnel acide carboxylique (-COOH) et un groupement fonctionnel amine (-NH2) portés par un même carbone appelé carbone α. Outre un Hydrogène, à ce carbone est associée une chaine carbonée constituant le radical : comme ce radical peut être différent, il distingue les différents acides aminés.
Des molécules carbonées présentant une partie moléculaire identique montrent des propriétés communes : l’ensemble des propriétés est la fonction et la partie moléculaire commune est le groupement fonctionnel correspondant.
 |
 |
 |
Les 20 acides aminés courants
[modifier | modifier le wikicode]On dénombre 20 acides aminés naturels variant par leur radical. Les 20 acides aminés sont:
Noms Abréviations Glycine GLY ou G Alanine ALA ou A Valine VAL ou V Leucine LEU ou L Isoleucine ILE ou I Sérine SER ou S Thréonine THR ou T Cystéine CYS ou C Méthionine MET ou M Acide aspartique ASP ou D Acide glutamique GLU ou E Asparagine ASN ou N Glutamine GLN ou Q Lysine LYS ou K Arginine ARG ou R Proline PRO ou P Phénylalanine PHE ou F Tyrosine TYR ou Y Tryptophane TRP ou W Histidine HIS ou H
Une planche décrivant les acides aminés peut être consultée ici.
Il existe des acides aminés, dits rares, comme la Sélénocystéine (SEC ou U), la Pyrrolysine (PYL ou J)…
Ionisation des Acides aminés
[modifier | modifier le wikicode]Les acides aminés sont des molécules amphotères, c'est-à-dire qu’ils se comportent comme des acides en milieu basique (alcalin) et comme des bases en milieu acide. Ainsi l'acide aminé devient un cation en milieu acide (structure sur la gauche) et un anion en milieu basique (structure sur le droit). La structure du milieu est la forme zwitterion de l'acide aminé neutre. Comme on peut ioniser les acides aminés, on pourra de cette manière les séparer d’un mélange en utilisant la technique de l'électrophorèse.



