Utilisateur:H'arnet/Archives BàS
Recherche d'une présentation des images dans une leçon
[modifier | modifier le wikicode]Je recherche à mettre des images à côté du texte avec menu déroulant : pouvoir lire en voyant mais sans que cela prenne trop de place à l’affichage de la page.
Il y a des problèmes d'instabilité : notamment à l'ouverture du deuxième le premier cadre se ballade des fois oui des fois non. En mode prévisualisation c’est stable, en mode page cela est plus instable.
Cela vient-il du moteur Wiki ou d'une mauvaise syntaxe ? Y a t'il une solution ? J’aimerai ne pas avoir à abandonner cette modalité d'intégration des images dans une leçon.
Ci-dessous, la présentation d'une partie de page sur l'eau avec :
- ce qui existe actuellement sur la page,
- ce que je voudrais.
Qu'en pensez-vous ? Lisibilité de la page - facilité d’utilisation mais surtout charge de syntaxe pouvant géner l'affichage.
Voilà le doc
Présentation actuelle
[modifier | modifier le wikicode]La Vie est liée à l'eau d’abord parce qu'elle est apparue dans l'eau, ensuite parce que la proportion d'eau chez les êtres vivants est, sauf dans certaines parties, l'élément chimique le plus abondant en masse (de l’ordre des 2/3 en moyenne) et enfin parce que l'eau est le solvant de la Vie qui permet les transports et les échanges au sein des organismes. Cette importance de l'eau est due à ses propriétés physico-chimiques que nous allons commencer par évoquer.
Composition et structure
[modifier | modifier le wikicode]
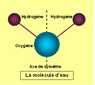
L'eau est une espèce chimique constituée de deux atomes d'Hydrogène liés à un atome d'oxygène : sa formule chimique est H2O.
Les hydrogènes sont liés à l'oxygène par des liaisons de covalence : chaque hydrogène a en commun deux électrons avec l'atome d'oxygène, ce qui sature l'orbitale de l'hydrogène avec deux électrons et la deuxième orbitale à 8 électrons (6 initiaux et un apporté par chacun des 2 hydrogènes) de l’oxygène.
L'angle entre les deux liaisons H-O est de 104°. La bissectrice de cet angle constitue un axe de symétrie bilatérale.
Bipolarité
[modifier | modifier le wikicode]
L'électron apporté par chacun des hydrogènes se trouve sur une orbitale plus proche du noyau de l'oxygène et aussi plus éloigné du noyau d'hydrogène qu’il ne l'était dans l'hydrogène natif (atome d'hydrogène non lié). Ainsi, les charges électriques dans la molécule d'eau sont réparties de façon asymétrique : une légère surcharge négative apparaît du côté de l'oxygène, pôle négatif, alors qu'un déficit de charges négatives crée une légère surcharge positive du côté des hydrogènes, pôle positif.
L'eau est une molécule bipolaire.
Comme les zones positives et négatives s'attirent, les molécules d'eau peuvent se retrouver associées entre elles par des liaisons dites liaisons hydrogènes.
Sur chaque pôle d'une molécule d'eau peuvent se lier plusieurs molécules d'eau et au niveau des pôles opposés de ceux liés à la première molécule d’autres molécules d’eau pourront se lier. Il peut se former ainsi des liaisons hydrogènes dans tout le volume d’eau.
Cela donne à la surface de l’eau liquide une cohésion capable de supporter des charges : c’est la tension superficielle de l’eau.
Une plaque de plomb de grande surface par rapport à son épaisseur, déposée bien à plat et doucement à la surface de l’eau ne coule pas. Des animaux de petite taille et de faible masse peuvent se déplacer à la surface de l’eau en utilisant la tension superficielle de l’eau
Présentation recherchée visible même si non aboutie
[modifier | modifier le wikicode]Composition et structure
[modifier | modifier le wikicode]| Schéma de la molécule d'eau |
L'eau est une espèce chimique constituée de deux atomes d'Hydrogène liés à un atome d'oxygène : sa formule chimique est H2O.
Les hydrogènes sont liés à l'oxygène par des liaisons de covalence : chaque hydrogène a en commun deux électrons avec l'atome d'oxygène, ce qui sature l'orbitale de l'hydrogène avec deux électrons et la deuxième orbitale à 8 électrons (6 initiaux et un apporté par chacun des 2 hydrogènes) de l’oxygène.
L'angle entre les deux liaisons H-O est de 104°. La bissectrice de cet angle constitue un axe de symétrie bilatérale.
Bipolarité
[modifier | modifier le wikicode]| Schéma de la molécule d'eau bipolaire |
L'électron apporté par chacun des hydrogènes se trouve sur une orbitale plus proche du noyau de l'oxygène et aussi plus éloigné du noyau d'hydrogène qu’il ne l'était dans l'hydrogène natif (atome d'hydrogène non lié). Ainsi, les charges électriques dans la molécule d'eau sont réparties de façon asymétrique : une légère surcharge négative apparaît du côté de l'oxygène, pôle négatif, alors qu'un déficit de charges négatives crée une légère surcharge positive du côté des hydrogènes, pôle positif.
L'eau est une molécule bipolaire.
Comme les zones positives et négatives s'attirent, les molécules d'eau peuvent se retrouver associées entre elles par des liaisons dites liaisons hydrogènes.
Sur chaque pôle d'une molécule d'eau peuvent se lier plusieurs molécules d'eau et au niveau des pôles opposés de ceux liés à la première molécule d’autres molécules d’eau pourront se lier. Il peut se former ainsi des liaisons hydrogènes dans tout le volume d’eau.
Cela donne à la surface de l’eau liquide une cohésion capable de supporter des charges : c’est la tension superficielle de l’eau.
Une plaque de plomb de grande surface par rapport à son épaisseur, déposée bien à plat et doucement à la surface de l’eau ne coule pas. Des animaux de petite taille et de faible masse peuvent se déplacer à la surface de l’eau en utilisant la tension superficielle de l’eau.
Présentation recherchée allégée visible même si non aboutie
[modifier | modifier le wikicode]Composition et structure
[modifier | modifier le wikicode]L'eau est une espèce chimique constituée de deux atomes d'Hydrogène liés à un atome d'oxygène : sa formule chimique est H2O.
Les hydrogènes sont liés à l'oxygène par des liaisons de covalence : chaque hydrogène a en commun deux électrons avec l'atome d'oxygène, ce qui sature l'orbitale de l'hydrogène avec deux électrons et la deuxième orbitale à 8 électrons (6 initiaux et un apporté par chacun des 2 hydrogènes) de l’oxygène.
L'angle entre les deux liaisons H-O est de 104°. La bissectrice de cet angle constitue un axe de symétrie bilatérale.
Bipolarité
[modifier | modifier le wikicode]L'électron apporté par chacun des hydrogènes se trouve sur une orbitale plus proche du noyau de l'oxygène et aussi plus éloigné du noyau d'hydrogène qu’il ne l'était dans l'hydrogène natif (atome d'hydrogène non lié). Ainsi, les charges électriques dans la molécule d'eau sont réparties de façon asymétrique : une légère surcharge négative apparaît du côté de l'oxygène, pôle négatif, alors qu'un déficit de charges négatives crée une légère surcharge positive du côté des hydrogènes, pôle positif.
L'eau est une molécule bipolaire.
La bipolarité de l'eau permet aux molécules d'eau de s'associer.
Comme les zones positives et négatives s'attirent, les molécules d'eau peuvent se retrouver associées entre elles par des liaisons dites liaisons hydrogènes.
Sur chaque pôle d'une molécule d'eau peuvent se lier plusieurs molécules d'eau et au niveau des pôles opposés de ceux liés à la première molécule d’autres molécules d’eau pourront se lier. Il peut se former ainsi des liaisons hydrogènes dans tout le volume d’eau.
Cela donne à la surface de l’eau liquide une cohésion capable de supporter des charges : c’est la tension superficielle de l’eau.
Une plaque de plomb de grande surface par rapport à son épaisseur, déposée bien à plat et doucement à la surface de l’eau ne coule pas. Des animaux de petite taille et de faible masse peuvent se déplacer à la surface de l’eau en utilisant la tension superficielle de l’eau.
Présentation recherchée allégée visible modif 1 Sharayanan
[modifier | modifier le wikicode]Composition et structure
[modifier | modifier le wikicode]L'eau est une espèce chimique constituée de deux atomes d'Hydrogène liés à un atome d'oxygène : sa formule chimique est H2O.
Les hydrogènes sont liés à l'oxygène par des liaisons de covalence : chaque hydrogène a en commun deux électrons avec l'atome d'oxygène, ce qui sature l'orbitale de l'hydrogène avec deux électrons et la deuxième orbitale à 8 électrons (6 initiaux et un apporté par chacun des 2 hydrogènes) de l’oxygène.
L'angle entre les deux liaisons H-O est de 104°. La bissectrice de cet angle constitue un axe de symétrie bilatérale.
Bipolarité
[modifier | modifier le wikicode]L'électron apporté par chacun des hydrogènes se trouve sur une orbitale plus proche du noyau de l'oxygène et aussi plus éloigné du noyau d'hydrogène qu’il ne l'était dans l'hydrogène natif (atome d'hydrogène non lié). Ainsi, les charges électriques dans la molécule d'eau sont réparties de façon asymétrique : une légère surcharge négative apparaît du côté de l'oxygène, pôle négatif, alors qu'un déficit de charges négatives crée une légère surcharge positive du côté des hydrogènes, pôle positif.
L'eau est une molécule bipolaire.
La bipolarité de l'eau permet aux molécules d'eau de s'associer.
Comme les zones positives et négatives s'attirent, les molécules d'eau peuvent se retrouver associées entre elles par des liaisons dites liaisons hydrogènes.
Sur chaque pôle d'une molécule d'eau peuvent se lier plusieurs molécules d'eau et au niveau des pôles opposés de ceux liés à la première molécule d’autres molécules d’eau pourront se lier. Il peut se former ainsi des liaisons hydrogènes dans tout le volume d’eau.
Cela donne à la surface de l’eau liquide une cohésion capable de supporter des charges : c’est la tension superficielle de l’eau.
Une plaque de plomb de grande surface par rapport à son épaisseur, déposée bien à plat et doucement à la surface de l’eau ne coule pas. Des animaux de petite taille et de faible masse peuvent se déplacer à la surface de l’eau en utilisant la tension superficielle de l’eau.
Présentation recherchée allégée visible modif 2 Sharayanan
[modifier | modifier le wikicode]Composition et structure
[modifier | modifier le wikicode]L'eau est une espèce chimique constituée de deux atomes d'Hydrogène liés à un atome d'oxygène : sa formule chimique est H2O.
Les hydrogènes sont liés à l'oxygène par des liaisons de covalence : chaque hydrogène a en commun deux électrons avec l'atome d'oxygène, ce qui sature l'orbitale de l'hydrogène avec deux électrons et la deuxième orbitale à 8 électrons (6 initiaux et un apporté par chacun des 2 hydrogènes) de l’oxygène.
L'angle entre les deux liaisons H-O est de 104°. La bissectrice de cet angle constitue un axe de symétrie bilatérale.
Bipolarité
[modifier | modifier le wikicode]L'électron apporté par chacun des hydrogènes se trouve sur une orbitale plus proche du noyau de l'oxygène et aussi plus éloigné du noyau d'hydrogène qu’il ne l'était dans l'hydrogène natif (atome d'hydrogène non lié). Ainsi, les charges électriques dans la molécule d'eau sont réparties de façon asymétrique : une légère surcharge négative apparaît du côté de l'oxygène, pôle négatif, alors qu'un déficit de charges négatives crée une légère surcharge positive du côté des hydrogènes, pôle positif.
L'eau est une molécule bipolaire.
La bipolarité de l'eau permet aux molécules d'eau de s'associer.
Comme les zones positives et négatives s'attirent, les molécules d'eau peuvent se retrouver associées entre elles par des liaisons dites liaisons hydrogènes.
Sur chaque pôle d'une molécule d'eau peuvent se lier plusieurs molécules d'eau et au niveau des pôles opposés de ceux liés à la première molécule d’autres molécules d’eau pourront se lier. Il peut se former ainsi des liaisons hydrogènes dans tout le volume d’eau.
Cela donne à la surface de l’eau liquide une cohésion capable de supporter des charges : c’est la tension superficielle de l’eau.
Une plaque de plomb de grande surface par rapport à son épaisseur, déposée bien à plat et doucement à la surface de l’eau ne coule pas. Des animaux de petite taille et de faible masse peuvent se déplacer à la surface de l’eau en utilisant la tension superficielle de l’eau.
Une ébauche pour ouvrir une fenêtre déroulante de compléments
[modifier | modifier le wikicode]
|
|
Voilà une première proposition pour mettre des compléments dans une leçon. Pour l'instant il n'y a qu'une image dans le mode afficher mais je voudrais y mettre du texte et peut-être des images.
À voir à quoi cela peut aboutir.
|
|
|
--H'arnet 6 septembre 2008 à 11:58 (UTC)
Tableau à 3 colonnes avec choix d'affichage
[modifier | modifier le wikicode]1er essai
texte sans image : problème le texte est en centré.
2e essai
Texte avec image : problème tout est centré et les deux parties sont décalées et non pas au même niveau.

|
1 |
|
|---|
3e essai Texte avec image : si l'aspect de l’affichage déployé est bon par contre la partie afficher apparaît à l'ouverture.

|
Complément 1 : Ce qui s'affiche Dans le cas de complément voire d'illustration complémentaire, il vaudrait mieux que cela n'apparaisse pas d'emblée. Par contre dans les cours de niveaux inférieurs, il est bon d'étendre les thèmes sur des applications des phénomènes décrits dans la vie de tous les jours de tout à chacun. Une boîte déroulante semble la plus appropriée d'autant que cela donne au lecteur un semblant de choix et d'activité. |

|
4e essai
Texte et image mais en distribution trois lignes et pas trois colonnes pour la partie afficher
Complément 1 : Titre de ce qui s'affiche  Dans le cas de complément voire d'illustration complémentaire, il vaudrait mieux que cela n'apparaisse pas d'emblée. Par contre dans les cours de niveaux inférieurs, il est bon d'étendre les thèmes sur des applications des phénomènes décrits dans la vie de tous les jours de tout à chacun. Une boîte déroulante semble la plus appropriée d'autant que cela donne au lecteur un semblant de choix et d'activité. |
5e essai
Complément 1 : Titre de ce qui s'affiche
|
6e essai
C1
|
 Complément 1 : titre de ce qui s'affiche
Dans le cas de complément voire d'illustration complémentaire, il vaudrait mieux que cela n'apparaisse pas d'emblée. Par contre dans les cours de niveaux inférieurs, il est bon d'étendre les thèmes sur des applications des phénomènes décrits dans la vie de tous les jours de tout à chacun. Une boîte déroulante semble la plus appropriée d'autant que cela donne au lecteur un semblant de choix et d'activité. |
7e essai
texte sans image : le texte n'est plus centré comme dans l'essai 1 mais est en gras ?.
| 1 | Complément 1 : ce qui s'affiche Dans le cas de complément voire d'illustration complémentaire, il vaudrait mieux que cela n'apparaisse pas d'emblée. Par contre dans les cours de niveaux inférieurs, il est bon d'étendre les thèmes sur des applications des phénomènes décrits dans la vie de tous les jours de tout à chacun. Une boîte déroulante semble la plus appropriée d'autant que cela donne au lecteur un semblant de choix et d'activité. |
|---|
Modèle Utilisateur Atelier graphique
[modifier | modifier le wikicode]Atelier graphique Je participe à l'Atelier graphique de Wikiversité.
|