Structure de l'atome/Isotope
Définition et propriétés
[modifier | modifier le wikicode]Découverte
[modifier | modifier le wikicode]Nous devons la découverte des isotopes à Sir Joseph John Thomson qui en 1892 à la suite d'une expérience où il étudiait la composition de mélange d'ions, il découvrit que pour un même atome, deux masses différentes correspondaient. Aujourd'hui, plus de 2800 isotopes ont été découverts dont 2500 sont radioactifs.
Définition
[modifier | modifier le wikicode]Deux atomes de même symbole peuvent être décris comme isotopes à partir du moment où l'un possède plus ou moins de neutrons. En revanche, deux atomes isotopes possèdent le même nombre de protons et d'électron. Ils appartiennent donc tous les deux au même élément chimique (puisque caractérisé par le nombre Z de protons) mais n'ont pas la même masse et pas le même nombre de nucléons A.
Exemple : si l’on prend comme atome le carbone :
: atome stable que l’on trouve dans le tableau périodique des éléments.
Et voila un de ces isotopes : : on remarque que le nombre de protons restent le même : 6, alors que le nombre de nucléons varient, il passe de 12 à 14 soit 2 neutrons en plus.
Propriétés
[modifier | modifier le wikicode]Les isotopes d'un même élément sont pratiquement les mêmes puisque le nombre électrons ne varient pas, un des facteurs qui peut par contre varier est la vitesse de réaction d'une solution.
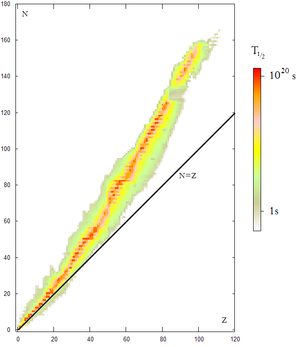
Un surplus ou une carence de neutron(s) modifient la structure interne du noyau et par la même occasion sa stabilité, c’est pourquoi une grande partie des isotopes sont radioactifs (environ 2500).
Un graphe a, au cours du temps et après de nombreuses expériences, pu être tracé, il représente le temps de désintégration des noyaux en fonction leur numéro atomique Z et de leur nombre de neutron.
Remarque : Sur les 118 éléments que comptent le tableau de Mendeleïev, environ 80 ont des isotopes stables (l'hydrogène : et le deutérium : , ...) mais tous les autres ne possèdent que des isotopes non stables avec des durées de vie variant beaucoup (le radium : et le Thorium X : )
Exercice
[modifier | modifier le wikicode]








