Structure de l'atome/Atome
Un premier modèle
[modifier | modifier le wikicode]L'atome peut être considéré comme un noyau sphérique central (composé des protons et neutrons) autour duquel gravite un cortège électronique (les électrons). Il a un diamètre d'environ 0,1 nm = 10-10 m (= 1 Angström). La majeure partie de la masse de l'atome est concentrée dans le noyau qui lui a un diamètre de l’ordre de 10-15 m = 1 Fermi. Vulgairement, il s'agit d'un grain de matière.
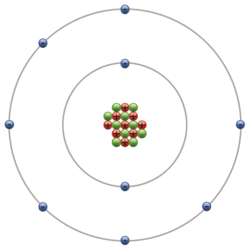
Le noyau est composé de deux sortes de particules, appelées nucléons :
- les neutrons, particules de charge électrique nulle
- les protons, particules de charge électrique positive
La masse du proton étant très proche de celle du neutron, il est pratique de caractériser un noyau par son nombre de nucléons, appelé nombre de masse.
La charge électrique d'un atome est neutre, car le nombre d'électrons (chargés négativement) du nuage électronique (ou cortège électronique) est égal au nombre de protons (chargés positivement) présents dans le noyau.
Symbolisation
[modifier | modifier le wikicode]L'élément est le nom des corps simples qui ne se décomposent jamais au cours des réactions chimiques. La classification périodique, appelée aussi tableau de Mendéleiev regroupe tous les éléments chimiques connus.
|
 |
|
On peut connaître N le nombre de neutrons de l'élément en faisant la différence : N = A - Z
Exemples
[modifier | modifier le wikicode]| Hydrogène
|
Carbone
|
Chlore
|
Uranium
|
| 1 proton | 6 protons | 17 protons | 92 protons |
| 0 neutron | 6 neutrons | 18 neutrons | 146 neutrons |
| 1 électron | 6 électrons | 17 électrons | 92 électrons |
Exercices
[modifier | modifier le wikicode]






