Introduction à la science des matériaux/Diagrammes binaires
Résumé
[modifier | modifier le wikicode]Nous allons étudier les transformations de la matière en fonction de la température.
Introduction
[modifier | modifier le wikicode]La matière change d'état selon la pression et la température. Par exemple, l'eau pure sous pression atmosphérique est sous forme de glace en dessous de 0 °C et sous forme de vapeur au dessus de 100 °C ; le phénomène est un peu plus complexe puisque l'eau peut s'évaporer à température ambiante, mais on n'a jamais d'eau liquide au-dessus de 100 °C.
Nous allons ici regarder les changements solide-liquide, mais aussi les transformations à l'état solide, toujours sous pression atmosphérique. Nous ne prendrons en compte que la température et la composition chimique de la matière.
Exemple : eau+sel
[modifier | modifier le wikicode]
On dit que « le sel fait fondre la glace », ce phénomène est utilisé en hiver (salage des routes). En fait, il faudrait dire « la température de fusion du mélange eau+sel dépend de la teneur en sel » ; par sel, il faut comprendre chlorure de sodium NaCl.
On prend un mélange eau+sel, on le refroidit et on regarde à quelle température il commence à se former des cristaux. On peut tracer le graphique de cette température en fonction de la teneur en sel. On remarque que l’on a un minimum de −21 °C pour 22 % de sel en masse ; on parle d'« eutexie » (du grec eutêksia « bien fondre », fusion facile).
Comme il ne s'agit pas d'un corps pur, la température continue à baisser en cours de solidification. On peut donc aussi tracer la température à laquelle tout devient solide en fonction de la teneur en sel. On remarque que cela fait une droite à −21 °C, à l'exception des très faibles teneurs en sel.
Cette courbe est appelée « diagramme binaire » ou « diagramme d'équilibre ».
Construction d'un diagramme d'équilibre
[modifier | modifier le wikicode]
Pour détecter le début et la fin de la solidification, on utilise une courbe d'analyse thermique : on fait un mélange liquide, on le fait refroidir et l’on mesure l'évolution de sa température T en fonction du temps t :
- dans le cas d'un solide, la température suit une courbe régulière ayant pour asymptote la température ambiante (1) ;
- si l’on a un corps pur, la courbe présente un plateau correspondant à la solidification : la chaleur dégagée par la solidification compense le refroidissement, la température reste constante durant la solidification (2) ;
- dans le cas d'un alliage, la température évolue durant la solidification (3) ou (4), la chaleur dégagée par la solidification ne compense pas complètement le refroidissement ; les ruptures de pentes de la courbe marquent le début de la solidification (liquidus) et la fin de la solidification (solidus).
Définitions
[modifier | modifier le wikicode]
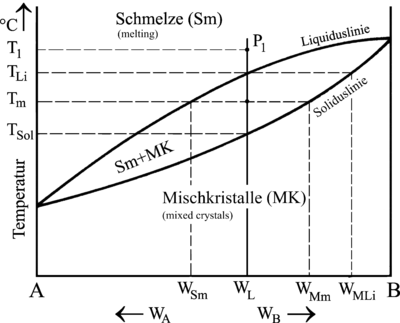
- Liquidus, solidus
Sur le diagramme binaire, la courbe du haut correspond au liquidus, c'est-à-dire à la température au dessus de laquelle il n'y a que du liquide ; la courbe du bas correspond au solidus, c'est-à-dire à la température en dessous de laquelle il n'y a que du solide.
- Phase
Une phase est une substance homogène, ayant les mêmes propriétés partout.
En science des matériaux, nous considérons une définition plus vaste : une phase est un milieu dont les propriétés varient de manière continue et lente. Les propriétés du milieu peuvent varier d'un bout à l'autre, tant que localement on a une impression d'homogénéité.

Un liquide au repos forme toujours une phase unique, mais le liquide peut contenir une phase solide (suspension ou précipitation). Un liquide agité peut présenter une dispersion de gouttelettes de phases différentes (émulsion), à l'instar de la vinaigrette ; si le système est laissé au repos, les phases se séparent et forment deux couches.

Un solide peut contenir plusieurs phases, à l'instar du nougat.

- Solution solide
Une solution solide est une situation où un élément est dispersé au sein d'un cristal. L'élément est sous forme d’atomes interstitiels ou de substitution.
Phases et cristallographie
[modifier | modifier le wikicode]Il existe une multitude de cas possibles, mais nous n'en verrons que les trois principaux :
- diagramme à fuseau unique, dit « à miscibilité complète » ;
- diagramme à eutectique unique ;
- diagramme à eutectique et à eutectoïde.
Diagrammes à miscibilité complète
[modifier | modifier le wikicode]
Dans certains cas, les deux éléments forment une solution solide de même structure cristalline, au paramètre de maille près. C'est le cas si
- les éléments pur cristallisent dans le même réseau ;
- ont des rayons atomiques proches (écart inférieur à 15 %) ;
- et ont des propriétés physiques et chimiques proches, en particulier des électronégativités (capacité à attirer les électrons) proches.
C'est par exemple l'or et l’argent (Au-Ag) ou le cuivre et le nickel (Cu-Ni).
On a typiquement un diagramme de phase à un seul fuseau.

On a donc une solution solide unique, qui évolue de manière continue avec la composition.
La courbe d'analyse thermique correspond au cas no 3 du graphique ci-dessus : elle ne présente pas de plateau horizontal.
Diagramme à miscibilité partielle
[modifier | modifier le wikicode]Dans la plupart des cas, la solubilité d'un élément dans un autre est limitée. Le principe est le même que pour la saturation des solutions aqueuses : si l’on dépasse une certaine teneur, appelée limite de solubilité, on observe de la précipitation, les atomes se réorganisent localement pour former des « composés définis », c'est-à-dire ayant une composition fixe (ou tout du moins admettant peu d'écarts). On va donc avoir des « lignes verticales » sur le diagramme binaire, correspondant aux limites de solubilité ; ces lignes s'appellent « solvus ».

Il existe plusieurs cas possibles, mais celui qui nous concerne est celui de l'eutexie. Prenons le cas des alliages plomb-étain (Pb-Sn), qui présente un diagramme simple.
le solidus et le liquidus se rejoignent au point le plus bas du liquidus. L’eutectique, qui est l'alliage dont la composition correspond à ce point, se solidifie donc à température constante, comme les corps purs (courbe 2 ci-dessus).

Ce diagramme comporte six zones :
- la zone liquide L, en haut ;
- la zone solide α, qui est une solution solide de B dans A (A est majoritaire) ;
- la zone solide β, qui est une solution solide de A dans B (B est majoritaire) ;
- la zone solide α+β, où les deux solutions solides sont présentes côte à côte, on a des cristaux d'α et des cristaux de β ;
- les deux zones liquide + solide :
- cristaux de solution solide α dans du liquide, L+α,
- cristaux de solution solide β dans du liquide, L+β.

Les cristaux d'eutectique sont en général des assemblages de cristaux des phases α et β :
- soit sous forme de lamelles ;
- soit sous forme de globules.
L'image ci-contre est schématique ; les cristallites ne sont en réalité pas aussi réguliers, les lamelles ne sont pas strictement planes et de largeur fixe, les globules ne sont pas sphériques mais plutôt prismatiques (suivant les plans cristallographiques denses).

Dans la zone solide, de gauche à droite :
- dans la zone α, on a une solution solide unique ;
- puis, à gauche de l'eutectique — zone dite hypoeutectique —, on a
- hors de la « zone d'influence de l'eutectique », des cristaux de α et quelques cristaux de β,
- dans la zone d'influence de l'eutectique, des cristaux de d'eutectique et des cristaux de phase α ;
- à la composition eutectique E, on n'a bien entendue que de l'eutectique ;
- à droite de l'eutectique — zone dite hypereutectique —, on a
- dans la zone d'influence de l'eutectique, des cristaux d'eutectique et de phase β,
- hors de la zone d'influence de l'eutectique, des cristaux de β et quelques cristaux de α ;
- dans la zone β, on a une solution solide unique.
Polymorphisme et eutectoïde
[modifier | modifier le wikicode]
On peut aussi avoir des changements de forme cristalline en phase solide : un métal a une structure donnée à basse température, et une autre structure à haute température. C'est le cas par exemple du fer pur :
- en dessous de 912 °C, il est cubique centré (fer α ou ferrite) ;
- entre 912 °C et 1 394 °C, il est cubique à faces centrées (fer γ ou austénite) ;
- entre 1 394 °C et la fusion (1 538 °C), il est à nouveau cubique centré (fer δ).
Ces changements de forme portent le nom de polymorphisme ; pour les éléments purs, on utilise le terme d'allotropie. On a donc trois formes allotropiques du fer : α, γ et δ.

Un diagramme d'un alliage présentant du polymorphisme peut prendre des formes très variées. Dans certains cas, on a une forme en « aile de papillon » similaire à l'eutectique sauf que l’on est à l'intérieur de la phase solide. On parle alors d'eutectoïde (« similaire à un eutectique »).
Solidification
[modifier | modifier le wikicode]Considérons un diagramme à un fuseau AB (alliage à miscibilité complète), et un liquide de composition c0 qui refroidit dans une lingotière (moule de forme globalement parallélépipédique).
Composition chimique d'un lingot
[modifier | modifier le wikicode]
On part de la phase liquide, puis le système refroidit. La chaleur part par les parois de la lingotière — l'air est un bon isolant — donc le liquide est plus froid le long des parois. Les premiers cristaux se forment donc sur les parois, d'autant plus que la présence de défauts facilite la cristallisation, et ce lorsque la température atteint le liquidus.
Les premiers cristaux formés sont à l'équilibre avec le liquide ; leur concentration est donc déterminée par le solidus à cette température, elle est différente de la composition du liquide. Avec le diagramme ci-contre, les premiers cristaux sont donc plus pauvres en B ; ils ont une composition c1 < c0.
Ce fait est utilisé pour purifier les produits (recristallisation de produits organiques, fusion de zone pour le silicium utilisé en électronique) : les impuretés sont rejetées dans le liquide.

Au cours de la solidification, le liquide s'enrichit donc en B ; à une température donnée, la composition c’2 du liquide est donnée par le liquidus.
Le solidus, quant à lui, donne la composition moyenne c2 de la matière déjà solidifiée : le solide n’est pas homogène, les derniers cristaux formés sont pus riches en B que les premiers.

À la fin de la solidification, la composition moyenne du lingot est c0, mais le dernier cristal solidifié a la composition de la dernière goutte de liquide, c’3. C'est la partie la plus riche en B.
Le rejet des impuretés au cœur du solide est appelé « ségrégation ». Par exemple, le cœur d'un glaçon contient en général des bulles : l'air dissout dans l'eau est rejeté dans le liquide, et il ne reste à la fin plus que de l'air qui est piégé sous la surface de la glace.
La ségrégation joue un rôle important dans la soudure des aciers inoxydables : les impuretés, et en particulier le soufre et le phosphore, sont rejetés au centre du cordon de soudure. Ils abaissent la température de fusion, donc le centre met plus de temps à solidifier ; comme la tôle se déforme par la chaleur, ceci provoque une fissuration du cordon de soudure pendant la soudure (phénomène de fissuration à chaud). Cela impose de choisir soigneusement le métal servant à effectuer la soudure.

La composition des cristaux formés à chaque instant est donnée par une autre courbe : la composition c’’2 d'un cristal est inférieure à la composition moyenne du lingot c2 donnée par le solidus. La fin de solidification se fait à une température inférieure à celle donnée par le diagramme de phase.
En fait, la solidification se fait hors équilibre, puisque la composition du solide change selon l'endroit ; c’est la raison pour laquelle le diagramme binaire, qui est un diagramme d'équilibre, ne s'applique pas. On pourrait envisager une solidification à l'équilibre, c'est-à-dire suivant le solidus et avec un solide toujours homogène, pour des vitesses de refroidissement très lente, permettant au solide de s'homogénéiser par diffusion. Dans la pratique, on préfère souvent réchauffer le lingot — recuit d'homogénisation — une fois solidifié pour activer la diffusion est avoir un solide plus homogène.
Courbes d'analyse thermique
[modifier | modifier le wikicode]Les courbes d'analyse thermique évoluent avec la composition, de gauche à droite :
- courbe à un plateau : A pur (solidification à température constante) ;
- courbes avec rupture de pente : solidification de l'alliage (traversée de la zone « Sm+MK », évolution de la température avec la solidification) ;
- courbe à un plateau : B pur (solidification à température constante).

|
|
Forme des cristaux dans un lingot
[modifier | modifier le wikicode]

La structure des cristaux qui se forment évolue également au cours de la solidification :
- les premiers cristaux se forment de manière aléatoire, on a donc contre la paroi de la lingotière une « peau » de cristaux de forme quelconque et sans orientation précise ; on parle de structure équiaxe ; la paroi étant très froide, les cristaux se forment rapidement, ils sont donc très petits ;
- puis, la croissance se fait de manière dirigée, on a donc des cristaux orientés perpendiculairement à la paroi ; on parle de structure colonnaire ou basaltique ;
- pour certains alliages, on a une formation de dendrites (cristaux en forme d'arbres) : le front de progression de la solidification s'ondule, les ondulations s'accentuent et on a une croissance rapide selon des directions précises ;
- au centre, on a à nouveau une structure équiaxe : la convection du liquide casse les extrémités des dendrites, ces petits morceaux forment des amorces de cristaux, qui ont donc une forme et une orientation quelconques.
Les bords ont donc des propriétés différentes du cœur, ce qui impose parfois de retailler dans le lingot, ou de mieux maîtriser le refroidissement (refroidissement lent, solidification dirigée).
Ces phénomènes se retrouvent aussi dans le cas des soudures. En particulier, pour la soudure des aciers inoxydables, on cherche à avoir des dendrites qui, de par leur forme, ont un rôle « d'accroche » et empêchent la fissuration en cours de soudure.
Avec un eutectique
[modifier | modifier le wikicode]Les courbes d'analyse thermique évoluent selon la composition. Ci-dessous, de gauche à droite :
- courbe à un plateau (A pur) ;
- courbe avec rupture de pente (traversée de la zone « Sm+A ») et plateau (solidification de l'eutectique) ;
- courbe à un plateau (eutectique pur) ;
- courbe avec rupture de pente (traversée de la zone « Sm+B ») et plateau (solidification de l'eutectique) ;
- courbe à un plateau (B pur).

|

|

Prenons l'exemple d'un alliage hypoeutectique, de composition inférieure à l'eutectique mais dans la zone d'influence de l'eutectique.
Au début de la solidification, il ne se forme que de la phase α ; la température continue à évoluer. Lorsque l’on s'approche du solidus, le liquide a quasiment une composition eutectique. Les derniers grains qui se forment sont donc des grains eutectiques ; la température reste constante.
La phase α est donc présente sous deux formes :
- sous la forme de lamelles de l'eutectique ;
- sous la forme de grains formés avant l'eutectique ; on parle de phase α proeutectique.
Frittage
[modifier | modifier le wikicode]
On peut éviter un certain nombre des inconvénients de la solidification grâce au frittage des poudres : l’objet est obtenu en compactant de la poudre dans un moule puis en effectuant un frittage (sintering) : les grains se « soudent » par diffusion ou fusion locale. Le procédé s'utilise pour les céramiques (cuisson des poteries), mais aussi pour les métaux : c’est le domaine de la métallurgie des poudres.
Le chauffage est « modéré » (on ne va pas jusqu'à la fusion), donc :
- on économise de l'énergie ;
- on maîtrise la structure du produit (structure équiaxe et taille des grains) ;
- on a une très faible contraction au refroidissement, et en particulier un faible retrait et pas de retassure, ce qui permet d’avoir une pièce « bonne » brute de frittage et réduit donc les opérations d'usinage.
Il faut appliquer de bonnes conditions de pression, de température et de durée pour maîtriser la porosité : soit avoir une faible porosité résiduelle, soit au contraire avoir une porosité permettant de retenir des liquides, comme dans le cas des coussinets frittés en bronze que l’on imprègne d'huile pour avoir une auto-lubrification.
Avec le frittage, on n'a pas de transformation de phase, sauf éventuellement une fusion localisée.
Transformations en phase solide
[modifier | modifier le wikicode]Description du phénomène
[modifier | modifier le wikicode]
En phase solide, les transformations de phase se font :
- par déplacement sur de petites distances : transformations « displacives », p. ex. changement de cristallisation (transformation allotropique) ;
- par migration sur de grandes distances (diffusion) : transformations « diffusives », p. ex. précipitation ou mise en solution.
Ces transformations interviennent lorsque, sur le diagramme binaire, la droite correspondant à la composition de l'alliage traverse plusieurs domaines solides. Étudions ce qui se passe lors du refroidissement d'un alliage à solubilité partielle avec eutectique.
Par rapport au diagramme générique que nous avons donné précédemment, les zones où la droite de composition coupe un solvus — frontière entre domaines solides — sont les zones biphasées α+β, situées à gauche et à droite du segment horizontal de l'eutectique. Ces zones sont dites « hors de l'influence de l'eutectique », puisqu’il ne se forme pas d'eutectique.

Prenons l'exemple d'une composition proche du A pur hors de la zone d'influence de l'eutectique (à gauche du point limitant la droite horizontale).
Lors du refroidissement, il se forme initialement uniquement de la phase α. Lorsque la température baisse, la solubilité de B dans A diminue : l'agitation des atomes étant plus faible, il y a « moins de place » dans les mailles du cristal A pour loger des atomes étrangers B. Les atomes B sont donc « chassés », ils diffusent (se déplacent) vers les zones où il y a plus de place, c'est-à-dire les joints de grain et en particulier les joints triples (intersection de trois grains de α).
Là, les atomes de B commencent à former de nouveaux cristaux de phase β.
Si l’on chauffe l'alliage, il se passe le phénomène inverse : au-dessus du solvus, les cristaux de β se dissolvent et les atomes de B diffusent pour se répartir dans la matrice α. On parle de « mise en solution ».
Cinétique du phénomène
[modifier | modifier le wikicode]Les transformations en phase solide mettent « un certain temps » à se produire. Ce temps est d'autant plus long que la température est basse : les atomes ont moins de mobilité. Les transformations displacives sont bien évidemment plus rapides que les diffusives, les atomes ayant moins de chemin à parcourir.

On représente ceci par les courbes « temps-température-taux de transformation », ou diagrammes TTT. Pour les construire, on effectue un refroidissement très rapide jusqu'à la température visée (trempe), on maintient un pallier à cette température, et l’on regarde le temps que met la transformation à se faire. On peut par exemple doser la quantité de phase qui s'est transformée avec des mesures de diffraction de rayons X. On peut aussi se servir d'une caractéristique physique, par exemple de la dureté du solide obtenu, pour quantifier la transformation.
L'échelle des temps est logarithmique.
On obtient typiquement une courbe avec un « nez » :
- au-dessus du solvus, il n'y a pas de transformation ;
- plus on est en dessous du solvus, plus la phase A est instable, donc plus la transformation est rapide, la durée de transformation diminue ;
- mais plus la température baisse, moins les atomes sont mobiles, donc la transformation se ralentit, les temps de transformation s'allongent ;
- pour les températures de trempe trop basses (hypertrempe), les atomes n'ont plus la possibilité de bouger et la transformation en peut plus avoir lieu ; on a de la phase A bien que celle-ci soit instable, on parle de phase « métastable ».

Si au contraire on réchauffe l'alliage sous forme B, le diagramme TTT est très différent : on n'a de transformation qu'au-dessus du solvus, et plus la température est élevée, moins la phase B est stable et plus les atomes sont mobiles. On a donc une diminution du temps de transformation avec la température.

Mais la courbe réelle de refroidissement d'une pièce un tant soit peu massive n’est pas étagée, elle est continue. Dans la pratique industrielle, on préfère donc utiliser des courbes de refroidissement continues, ou diagrammes TRC.
Traitements thermiques
[modifier | modifier le wikicode]
On effectue des traitements thermiques sur les alliages pour opérer des transformations en phase solide et modifier ainsi les caractéristiques physiques et mécanique du matériau. Les principales opérations sont :
- recuit (annealing) : chauffage, maintien en température pour laisser le temps aux transformations de se faire, puis refroidissement lent ; ce traitement sert à amener le métal à l’état d’équilibre et le rendre homogène, on chauffe en général juste au-dessus du solvus pour reformer totalement la phase stable lors du refroidissement, soit en dessous du solvus si l’on veut conserver la structure de base ;
- trempe (quenching) : chauffage au-dessus du solvus pour amener tout l'alliage dans la phase stable à haute température (éventuellement mise en solution de précipités), puis refroidissement rapide pour piéger une structure métastable.
- revenu (tempering) : traitement parfois appliqué après une trempe, consistant en un chauffage et maintien à une température inférieure au solvus, pour activer la diffusion des atomes et « annuler » une partie de la trempe ou permettre la formation de précipités.
Diagrammes ternaires
[modifier | modifier le wikicode]
Dans certains cas, on s'intéresse à l'alliage de trois éléments. On peut dans ce cas-là utiliser un diagramme ternaire : il s'agit d'un diagramme isotherme (pour une température donnée) en forme de triangle, chaque point correspondant à une composition de l'alliage.

Soit un diagramme ternaire pour trois éléments (ou composés) A, B et C. Chaque sommet correspond à un élément pur.
La composition correspondant à un point quelconque du diagramme se détermine comme suit : pour l'élément A,
- on trace la parallèle au côté opposé au sommet A ;
- on détermine l'intersection de cette droite avec le côté portant la mention « %A » ;
- la valeur est celle indiquée par l'échelle de ce côté.
Dans l'exemple ci-contre, le point rouge correspond donc à 20 % de A, 20 % de B et 60 % de C.
Voir aussi
[modifier | modifier le wikicode]- Annexe : Application à la géologie
- Barralis et Maeder (1991) p. 31-39
- Philibert et col. (1998) III-2 (p. 569-580), III-4.1 à 4.5 (p. 583-593), III-5 (p. 600-604)


