Expériences autour des cinq sens/Cinq sens: l'odorat
Le nez humain est un détecteur de molécules odorantes. Les esters sont des composés souvent utilisés comme additifs alimentaires pour les odeurs fruités. Nous proposons ici la synthèse de l'éthanoate d'isoamyle (odeur de banane), qui est l'un des constituants principaux de l'essence de banane artificielle. Cette synthèse peut illustrer une manipulation dans Expériences autour des cinq sens.
Utilisation en classe
[modifier | modifier le wikicode]Pour une activité expérimentale destinée à une classe de première STL-SPCL, on peut illustrer l'estérification pour la synthèse des molécules odorantes, qui se contextualise très bien pour l’application de cette synthèse dans les produits du quotidien (bonbon à la banane). Cette activité se place dans la séquence "Synthèses organiques" de la partie "Synthèses chimiques".
Réaction de la synthèse
[modifier | modifier le wikicode]
Tableau d'engagement
[modifier | modifier le wikicode]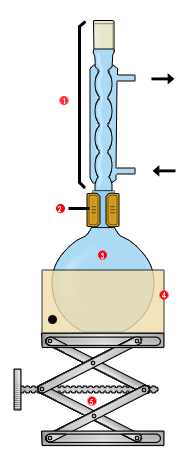
| Composé | M (g/mol) | Volume (mL) | mmol | Teb (°C) | Densité | Indice de réfraction |
|---|---|---|---|---|---|---|
| Alcool isoamylique (1) | 88,15 | 8 | 74 | 132 | 0,81 | 1,4053 |
| Acide acétique (2) | 60,05 | 15 | 262 | 139,6 | 1,049 | 1,3720 |
| Ethanoate d'isoamyle (3) | 130,19 | 140-142 | 1,3981 | |||
| H2SO4 | 4 | |||||
| Et2O | 74,12 | 2 x 10 | 34,5 | 0,7138 | 1,3506 | |
| Na2CO3 sat. | 2 x 10 |
Dispositif expérimental
[modifier | modifier le wikicode]Synthèse
[modifier | modifier le wikicode]Montage à reflux :
- Réfrigérant à boules
- Pince plate
- Ballon monocol contenant : 74mmol d'alcool isoamylique, 262 mmol d'acide acétique et 4mL de H2SO4 concentré, de la pierre ponce
- Chauffe-ballon
- Système élévateur
Les flèches représentent l’entrée et la sortie de l'eau dans le réfrigérant.
Traitement
[modifier | modifier le wikicode]
- Le ballon est refroidi puis son contenu est versé dans un bécher contenant 30g environ de glace pilée.
- Quand la glace a fondu, verser le mélange réactionnel dans une ampoule à décanter. La phase organique est en haut de l'ampoule à décanter et la phase aqueuse est en bas de la phase organique.
- La phase aqueuse est extraite deux fois avec 10 mL d'éther.
- Les phases organiques sont réunies et lavées deux fois avec 10 mL d'une solution saturée en carbonate de sodium.
- Après séchage de la phase organique sur du magnésium anhydre, le solvant est évaporé à l'évaporateur rotatif.
Caractérisation
[modifier | modifier le wikicode]- Caractérisation par IR
-
Spectre IR de l'alcool isoamylique
-
Spectre IR de l'Ester de banane
Produit de départ: alcool isoamylique
On remarque que la bande à 3332,73 cm-1 qui est caractéristique de l'élongation de la liaison O-H de la fonction alcool.
Produit de synthèse : ester de banane
La bande à 1781,44 cm-1 est caractéristique de l'élongation de la liaison C=O de l'ester.
La bande caractéristique de la fonction alcool du produit de départ à disparu au profit de l'apparition de la bande caractéristique de la fonction ester. On a donc synthétisé un ester à partir d'un alcool.
- Caractérisation par indice de réfraction
On trouve l'indice de réfraction à l'aide d'un réfractomètre : n = 1,397 (proche de la valeur théorique de l'indice de réfraction de l'éthanoate d'isoamyle)
Conclusion
[modifier | modifier le wikicode]Cette expérience menée dans le cadre de l'illustration d'une molécule odorante, a permis de fabriquer un arôme artificiel (de banane) réaliste qui a été caractérisé par une analyse du spectre IR et son indice de réfraction.
Référence
[modifier | modifier le wikicode]La chimie expérimentale,2. Chimie organique et minérale, Romain Barbe, Jean-François Le Maréchal; Ed. Dunod




