Conductimétrie/Conductance et conductivité
Conductance d’une solution électrolytique
[modifier | modifier le wikicode]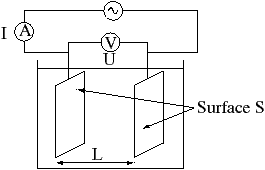
Facteurs influant La conductance G :
- est proportionnelle à la surface S des électrodes.
- est proportionnelle à l’inverse de la distance L entre les électrodes.
- dépend de la nature de la surface.
Le coefficient de proportionnalité est appelé conductivité de la solution électrolytique.
Le constructeur livre le conductimètre avec la valeur de la constante de cellule k=L/S.
Conductivité d’une solution électrolytique
[modifier | modifier le wikicode]Un conductimètre permet de mesurer la conductivité d'une solution électrolytique.

On mesure la conductivité de solutions aqueuses électrolytiques de concentrations molaires de soluté apporté connues. Ensuite on trace la courbe . La droite obtenue est appelée courbe d’étalonnage.

La conductivité σ d’une solution électrolytique augmente avec sa concentration et avec sa température ; elle dépend de la nature des ions en solutions. Elle ne dépend ni de la géométrie ni de l’état des électrodes de la cellule de conductimétrie. En effet ces paramètres sont intégrés dans la constante de cellule k.
La conductivité σ est caractéristique de la solution. La conductivité :
- est proportionnelle à la concentration pour des valeurs inférieures à ;
- dépend de la nature de l'électrolyte ;
- dépend de la température.
Conductivité molaire ionique
[modifier | modifier le wikicode]Définition
[modifier | modifier le wikicode]Chaque ion du soluté apporte sa contribution à la conductivité de la solution. La conductivité σ de la solution de chlorure de sodium est la somme de la conductivité des ions Na+ et Cl- :
La conductivité d’un ion Xi est proportionnelle à sa concentration pour des valeurs inférieures à . Le coefficient de proportionnalité λi est appelé conductivité molaire ionique.
La conductivité molaire ionique dépend de la température, de la nature du solvant et de l’ion considéré.
Conductivités molaires de quelques ions
[modifier | modifier le wikicode]Liste des conductivités ioniques molaires
Les valeurs de conductivité molaire ionique des ions oxonium et hydroxyde sont plus élevées que celles des autres ions : et à 25 °C.
Conductivité et conductivité molaire ionique
[modifier | modifier le wikicode]La conductivité σ d’une solution dépend de la nature des ions Xi présents dans la solution et de leur concentration [Xi].










![{\displaystyle \sigma _{i}=\lambda _{i}.[X_{i}]\left\lbrack {\begin{array}{lll}\sigma _{i}&{\rm {conductivit{\acute {e}}~de~l'ion}}&{\rm {en~S.m^{-1}}}\\\lambda _{i}&{\rm {conductivit{\acute {e}}~molaire~ionique}}&{\rm {en~S.m^{2}.mol^{-1}}}\\\left[X_{i}\right]&{\rm {concentration~molaire~de~l'ion}}&{\rm {en~mol.m^{-3}}}\end{array}}\right.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5f0a7d0588b280e546512f34bc5343e0c2234aa4)




![{\displaystyle \sigma =\sum _{i}\lambda _{i}.[X_{i}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bca818602918c441bdad78c01ba427c04386986a)