Air/Équation des gaz parfaits
Comment réagit le gaz parfait à température constante ?
[modifier | modifier le wikicode]Loi de Boyle-Mariotte
[modifier | modifier le wikicode]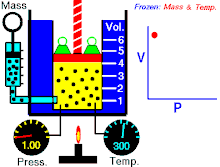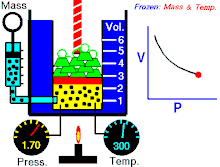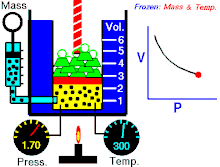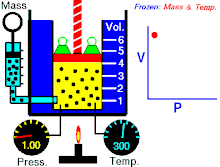
Si l'on mesure a un instant T, la pression P et le volume V d'un gaz confiné, et qu'on multiplie ces valeurs, on obtient une constante qui sera la même pour une autre configuration (d’où la forme hyperbolique de la courbe) si l'on prend soin de maintenir la température de ce gaz constante.
(à température constante)
avec:
- en Pa
- en m3
Il faut noter que comprimer un gaz confiné, induit un réchauffement (comme une pompe à vélo qui s’échauffe lorsque on gonfle un pneu, le décomprimer, un refroidissement (c'est le principe de fonctionnement d'un réfrigérateur).
De cette loi, on peut déduire le volume occupé par un gaz (parfait) suivant la pression, ou à l'inverse, la pression exercé sur un gaz (parfait) pour un volume donné:
Application de la Loi de Boyle-Mariotte : Si : pour une température du gaz et Si : avec Alors : et donc plus simplement :
On peut ainsi obtenir, avec une simple règle de 3, le volume occupé par un gaz après une compression ou décompression (différence entre et ), si l'on connaissait le volume initial :
Influence de la quantité de matière
[modifier | modifier le wikicode]P. V = n x Cste
Comment réagit le gaz en fonction de la température ? (Loi de Gay-Lussac )
[modifier | modifier le wikicode]
.
P.V = T x Cste (avec T en Kelvin)
Équation d'état du gaz parfait
[modifier | modifier le wikicode]P.V = n .R .T
- avec P en Pa
- V en
- n en mol
- R= 8,314 SI
- T en K (Kelvin = °C + 273)

















