Introduction à la chimie de l'eau/La molécule d'eau
La molécule d'eau possède certaines caractéristiques importantes par rapport aux chapitres suivants...
Généralités sur la polarité[modifier | modifier le wikicode]
La polarité est une caractéristique décrivant la répartition des charges négatives et positives dans un dipôle. La polarité d'une liaison ou d'une molécule est due à la différence d'électronégativité entre les éléments chimiques qui la composent, des différences de charge qu'elle induit, et à leur répartition dans l'espace.
Liaison[modifier | modifier le wikicode]
Dans une liaison, le doublet électronique peut ne pas être partagé équitablement entre les deux atomes : l'un des deux atomes peut avoir une force d'attraction sur le nuage électronique plus grande que l'autre (électronégativité différente).
A l'atome le plus électronégatif (qui attire à lui le doublet électronique) sera attribué une charge partielle négative, notée -δe (δ-), à l'autre une charge partielle positive, notée +δe (δ+)
'Conséquence :
- Lorsque la différence d'électronégativité est très faible, voire nulle, les charges partielles sont nulles (δe=0) et la liaison est complètement apolaire : le doublet électronique est réparti équitablement entre les atomes ;
- Lorsqu'au contraire la différence d'électronégativité est très grande, les charges partielles deviennent formelles (δe=1), la liaison perd alors de son caractère covalent pour tendre vers une liaison ionique pure : les atomes ne partagent plus un doublet, mais s'ionisent pour prendre une configuration de gaz rare, le moins électronégatif cédant un ou plusieurs électrons au plus électronégatif.
Molécule[modifier | modifier le wikicode]
- Si δ+ est confondu avec δ-, alors la molécule est apolaire.
- Si δ+ n’est pas confondu avec δ-, alors la molécule est polaire
Plus le moment dipolaire (norme=(distance entre les deux pôles)* (charges) ) est grand, plus la molécule est polaire.
H2O, une molécule dipolaire[modifier | modifier le wikicode]
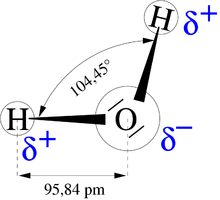
Ce schéma résume toute la situation quant à la molécule d'eau : deux pôles : le - au niveau de O et le + réparti entre les 2 H.


