Introduction à la science des matériaux/Le cristal parfait
Résumé
[modifier | modifier le wikicode]Nous étudions le modèle du cristal parfait, qui est un des modes d'organisation des atomes dans la matière solide. Nous en déduisons les propriétés que cette organisation confère à la matière.
Durée recommandée : 1 h.
Généralités
[modifier | modifier le wikicode]La cristallographie est la science décrivant les cristaux. Elle est née de l’observation de la forme extérieure des cristaux.
-
Cristaux de sel
-
Monocristal de protéine
-
Cristaux de niobium

Elle s’est consolidée grâce à la radiocristallographie (diffraction de rayons X sur des cristaux), qui a permis l'étude de l’organisation interne des cristaux.


L’organisation des atomes dans le cristal détermine :
- la forme possible de ses faces (clivage) ;
- les possibilités de déformation plastique (glissement des atomes entre eux) ;
- l’anisotropie des propriétés : les cristaux n'ont pas les mêmes propriétés selon la direction que l’on considère (rigidité, propriétés optiques, …) ;
- la possibilité « d’accueillir » des atomes étrangers (alliages, impuretés dans les « espaces vides »).
Le réseau cristallin
[modifier | modifier le wikicode]
Un cristal parfait est un empilement infini et régulier d’atomes ou de molécules.

Un cristal peut se représenter comme un motif qui se répète aux nœuds d’un réseau.
Dans le cadre du présent cours, nous prendrons souvent comme exemple des cristaux dont le motif est formé d'un seul atome ; c’est en effet le cas de la plupart des métaux purs. Cependant, ce n’est pas le cas général.

Le réseau peut être décomposé en cellules ayant les mêmes symétries que le réseau complet : ce sont les mailles élémentaires.

Le réseau peut être vu comme des mailles élémentaires qui se juxtaposent.
On classe les mailles selon leurs symétries :
- parallélépipèdes rectangles
-
cubique
-
tétragonal ou quadratique (base carrée)
-
Orthorhombique (base rectangulaire)
- parallélépipèdes droits
-
hexagonal (base losange à 120°)
-
monoclinique (base parallélogramme quelconque)
- parallélépipèdes obliques
-
rhomboédrique (tous les côtés sont égaux)
-
triclinique (parallélépipède quelconque)
Par ailleurs, les réseaux peuvent être
- simples : un nœud à chaque sommet ;
- centrés : + un nœud au centre ;
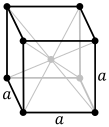
- à faces centrées : + un nœud au centre de chaque face ;
ce qui donne les 14 réseaux de Bravais.
| Système | Simple | Centré | À 2 faces centrées | À faces centrées |
|---|---|---|---|---|
| Cubique | 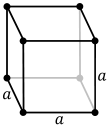 |
 |

| |
| Hexagonal |  |
|||
| Tétragonal |  |
 |
||
| Rhomboédrique |  |
|||
| Orthorhombique | 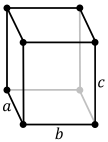 |
 |
 |

|
| Monoclinique |  |
 |
||
| Triclinique |  |
Exemples :
- Cubique centré (cc) : fer α (ferrite), tungstène, vanadium ;
- Cubique à faces centrées (cfc) : cuivre, aluminium, fer γ (austénite), nickel, or, plomb… tous les métaux ductiles ;
- Hexagonal : carbone graphite, titane.
Dans le cadre du présent cours, nous ne nous intéresserons qu'aux structures cubiques, qui sont les structures les plus courantes pour les métaux.
Ordre chimique
[modifier | modifier le wikicode]Un motif peut être formé de plusieurs atomes différents. Dans ce cas, on a un ordre chimique dans le cristal (alternance régulières des différents types d'atome).

Par exemple, la structure ci-contre, dite « CsCl » ou « B2 » (notation du journal Strukturbericht), ressemble à une structure cubique centrée. En fait, c’est une structure cubique simple. On a une alternance d'atomes ou d'ion selon la grande diagonale.
C'est le cas du chlorure de césium (CsCl)
- les ions Cl- occupent les sommets des cubes et les ions Cs+ occupent les centres des cubes, ou vice versa,
et de quelques alliages dits « ordonnés », comme l'aluminiure de fer FeAl par exemple
- les atomes Fe occupent les sommets des cubes et les atomes Al occupent les centres des cubes, ou vice versa.

La structure ci-contre, dite « NaCl » ou « B1 » (notation du journal Strukturbericht), est une structure cubique à faces centrées (cfc) avec alternance chimique le long des arêtes du cube. C'est le cas du sel de table (chlorure de sodium NaCl), du chlorure de potassium (KCl) et de la galène (PbS).
Relations géométriques
[modifier | modifier le wikicode]Réseau cubique centré
[modifier | modifier le wikicode]
Une maille élémentaire d'un réseau cubique centré (cc) contient deux motifs par maille, c'est-à-dire, dans le cas d'un cristal monoatomique, deux atomes par maille. En effet, les motifs situés aux sommets du cube sont partagés entre les huit mailles voisines ; on a donc :
- 8 sommets avec chacun 1/8 motif, 8 × 1/8 = 1 motif ;
- le motif central qui compte pleinement.

Considérons une arête du cube. Sa longueur est le paramètre de maille a. Deux atomes s'alignent sur cette arête, donc la distance entre les centre des atomes est a (problème des « piquets et des bouts de ficelle »).
Considérons la grande diagonale du cube. Cette diagonale a pour longueur . Trois atomes s'alignent sur cette diagonale, donc la distance entre les centres des atomes est . Donc les atomes sont au contact sur la grande diagonale et non sur les arêtes.
La longueur de la grande diagonale est donc égale à quatre fois le rayon atomique r :
- .
La compacité c est le rapport entre l'espace occupé par les atomes, considérés comme des sphères, et le volume de la maille. On a deux atomes par maille soit
C'est-à-dire que les atomes occupent environ 68 % du volume du cristal et que l’on a 32 % de vide.
La masse volumique mesurée pour le fer α, ou ferrite, de structure cubique centrée, vaut
- ρFe α = 7 874 kg/m3.
Par diffraction de rayons X, on détermine que le paramètre de maille vaut
- a = 2,87 Å.
On en déduit la masse molaire atomique MFe ainsi que le rayon atomique rFe :
- ;
- une maille a un volume
- V = (2,87⋅10-10)3 = 2,36⋅10−29 m3,
- et contient
- n = 2/N = 3,32⋅10−24 mol de fer,
- donc la masse d'une maille vaut
- m = ρFe αV = 7 874 × 2,36⋅10-29 = 1,86⋅10−25 kg
- et donc
- soit 56 g/mol.
Un calcul littéral nous donne
- .
- Note
- La valeur du rayon atomique retenue est légèrement différente : rFe = 126 pm.
Les relations géométriques dans la maille permettent donc de déterminer la compacité c et, à partir de valeurs mesurées expérimentalement (ρFe α, a), de déterminer le rayon atomique rFe et la masse molaire atomique MFe.
Réseau cubique à faces centrées
[modifier | modifier le wikicode]
- Exercice
- À partir de la description de la maille cubique à faces centrée ci-contre,
- déterminer le nombre d'atomes par maille ;
- calculer la relation entre le paramètre de maille a (longueur d'une arête du cube) et le rayon atomique rFe ;
- calculer la compacité c.
Comme précédemment, chacun des 8 motifs situés aux sommet sont partagés parc 8 mailles voisines, donc comptent pour 1/8. Par ailleurs, chacun des 6 motifs situés aux centres des faces sont partagés par 2 mailles voisines et comptent pour 1/2. Le nombre de motifs est donc :
- 8 × 1/8 + 6 × 1/2 = 4.

Le dessin ci-contre montre que les atomes au contact sont ceux situés sur une face. On a :
- .
La compacité vaut
- Exercice
- Le fer γ, également appelé austénite, a une structure cubique à faces centrées (cfc). À partir des données déterminées ci-dessus (rFe = 124 pm et MFe = 56 g/mol), déterminer le paramètre a de la maille et la masse volumique de l'austénite ρFe γ.
La formule ci-dessus nous donne immédiatement :
- .
Une maille élémentaire a un volume V = a3 et contient n = 4/NA atomes, elle représente donc une masse
- ;
donc, la masse volumique vaut
- .
Le réseau cubique à faces centrées a une compacité plus grande que le réseau cubique centré, donc logiquement, l'austénite a une masse volumique plus importante que la ferrite. CLa plupart des aciers inoxydables sont austénitiques, ils ont donc une masse volumique plus importante que la plupart des autres aciers.
Sites interstitiels
[modifier | modifier le wikicode]

L'empilement des atomes laisse de l'espace vide. Cet espace peut être occupé par de petits atomes, des atomes de faible numéro atomique Z, typiquement C, H, N.
Les endroits du cristal où les l'espace vide est maximal sont appelés sites interstitiels. Pour les réseaux cubiques centrés et cubiques à faces centrées, on distingue deux types de sites interstitiels :
- les sites octaédriques : c’est le vide entre six atomes formant un octaèdre, ce sont les sites les plus « spacieux » ;
- les sites tétraédriques : c’est le vide entre quatre atomes formant un tétraèdre.

Dans un réseau cubique centré, le diamètre de la plus grande sphère inscrite dans un site octaédrique vaut a - 2r, donc le rayon RO de cette sphère vaut
- .
- Exercice
- Calculer le rayon RO d'un site octaédrique d'un réseau cubique à faces centrées en fonction du rayon atomique r.

Comme précédemment, on a
- RO = a/2 - r
mais cette fois-ci :
- .
On voit donc que pour un même rayon atomique r, RO est 2,7 fois plus grand dans un réseau cubique à faces centrées que dans un réseau cubique centré. Dans le cas du fer (rFe = 1,26 Å) :
- ferrite (fer α, cc) : RO = 0,19 Å ;
- austénite (fer γ, cfc) : RO = 0,52 Å.
Cette notion de site interstitiel a une importance capitale en ce qui concerne les impuretés et les alliages, puisque de petits atomes peuvent se loger dans ces sites.
Déformation plastique et directions de glissement
[modifier | modifier le wikicode]
La déformation plastique se fait par « glissement » de « plans atomiques ». On peut voir cela comme les cartes d'un jeu de cartes qui glissent les unes sur les autres.

Un plan atomique est un ensemble des atomes situés sur un plan géométrique. Entre le début et la fin du glissement, la structure du cristal doit être la même ; seule la forme extérieure a changé. La distance de glissement minimale est donc la distance séparant deux atomes sur la rangée atomique le long de laquelle le plan glisse.
Le glissement va donc se faire essentiellement selon les directions les plus denses : la distance minimale étant plus courte, l'effort à fournir est moindre.

Sur la figure ci-contre, nous voyons que :
- sur la structure du haut, il n'y a que deux orientations denses, de glissement facile ;
- sur la structure du bas, il y en a trois.
La structure du bas se déforme donc plus facilement que celle du haut.
Ainsi, certains réseaux sont de fait plus ductiles que d'autres. Le réseau le plus ductile est le réseau cubique à faces centrées : c’est celui qui présente le plus de modes de glissement. Tous les métaux « mous » sont de structure cfc : or, argent;, plomb, cuivre, étain, aluminium, austénite, …
Bilan
[modifier | modifier le wikicode]Outre la forme extérieure des gemmes comme nous l'avions déjà vu, l'organisation atomique des cristaux permet de comprendre la relation entre :
- masse volumique et la masse molaire atomique ;
- la dimension des atomes et la masse volumique ;
- la dimension des atomes et l'espace disponible pour des impuretés et éléments d'alliage.