Changements d'états/Vaporisation et condensation
Vaporisation
[modifier | modifier le wikicode]Rappel sur la vaporisation
[modifier | modifier le wikicode]La vaporisation correspond au changement d'état liquide vers un état gazeux. Elle porte 3 noms, bien distincts, et qu’il faut surtout éviter de mélanger :
- On l'appelle évaporation lorsque le phénomène est lent. Il ne concerne que la surface d'un liquide

Mettez de l'eau dans une casserole et chauffez-la. Lorsque la température de celle-ci va se rapprocher de 100 °C (température correspondant au changement de l'état liquide à l'état gazeux pour l'eau) vous allez voir un brouillard s'échapper de la casserole (De la vapeur s'échappe, mais elle ne peut être vue, c’est un gaz invisible, de minuscules gouttelettes d'eau provenant de la condensation de la vapeur d'eau forment le brouillard visible). C’est l'évaporation.
- On l'appelle ébullition lorsque le phénomène est rapide. C'est-à-dire avec une formation de bulles de vapeur au sein du liquide

À la suite de l'exemple précédent vous continuez à chauffer l'eau. Lorsqu'elle va atteindre 100 °C, vous allez voir des bulles de vapeur remonter à la surface. C’est l"'ébullition. (Pour information les bulles qui remontent à la surface sont composées de vapeur mais aussi de gaz dissous dans l'eau qui sont expulsés de l'eau lorsqu’ils sont chauffés)
- On l'appelle caléfaction lorsque le phénomène est brutal. Il y a formation d'un film de vapeur autour d'une gouttelette de liquide

Lorsque vous faites tomber de l'eau sur une plaque chaude, vous pouvez voir les gouttes « sauter » sur la plaque. C’est la caléfaction. En réalité lorsque la gouttelette d'eau tombe sur la plaque, son contour va se vaporiser et sachant que la vapeur prend environ 10 fois plus de place que l'eau, la gouttelette d'eau va être propulsée ; d'où le fait que l’on voit ces gouttelettes d'eau « sauter ». (Il est déconseillé de réaliser cette dernière expérience car les plaques n'apprécient pas ce phénomène, surtout les plaques électriques qui risquent à force de se fissurer).
Chaleur latente de vaporisation
[modifier | modifier le wikicode]La chaleur latente de vaporisation est la quantité de chaleur qu’il faut fournir à 1 kg de liquide (à pression et température constantes) pour obtenir 1 kg de vapeur saturée.
L'unité est le Joule/kilogramme (J/kg) et est notée : Lv
À noter que pour un même corps, la valeur de la chaleur latente de vaporisation change avec la température :
- Voici la courbe représentative de la chaleur latente de vaporisation de l'eau : L=f(T) :

Comment mesure t-on cette chaleur latente de vaporisation ?
Pour bien comprendre la définition, on représente la courbe de la Température en fonction de la Chaleur :

1. Dans la première partie du graphique, à gauche, est représentée la chaleur d'échauffement. Dans cette partie, il n'y a que de l'eau. Si on imagine que l’on est à la pression atmosphérique, le point de départ de la courbe sera le 0 °C et le point d'arrivée de la première partie sera le 100 °C. Entre ces deux points, rien de compliqué, plus l’on veut augmenter la température de l'eau plus il faudra d'énergie, donc de chaleur.
2. Dans la deuxième partie du graphique, est représentée la chaleur latente de vaporisation. Si on imagine toujours que l’on est à la pression atmosphérique, la température sera de 100 °C dans toute cette portion. À gauche, on aura de l'eau, et plus on admettera de chaleur, plus cette eau se transformera en vapeur jusqu'à arriver à droite en vapeur saturée, où il n'y aura plus que de la vapeur. On appelle aussi cette partie état biphasique, car on est en présence d'eau et de vapeur.
La courbe suivante sera certainement plus parlante que cette longue phrase :
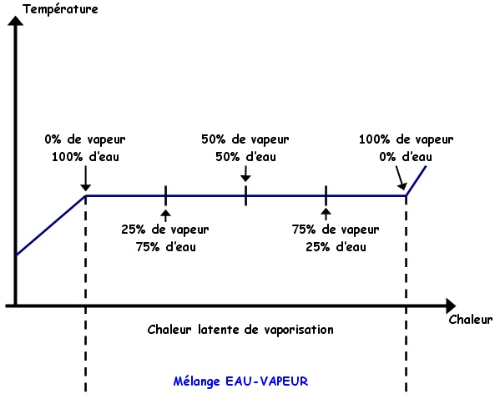
3. Dans la troisième et dernière partie, est représentée la chaleur de surchauffe. Dans cette partie il n'y a que de la vapeur. Si on imagine que l’on est à la pression atmosphérique, le point de départ de la courbe sera le 100 °C (le 100 °C en vapeur, c'est-à-dire à partir du point de vapeur saturée), et plus on admettra de chaleur plus l’on augmentera la température de la vapeur.
Chaleur totale
[modifier | modifier le wikicode]La chaleur totale est la quantité de chaleur qu’il faut fournir à 1 kg d'eau à la température initiale pour le transformer en 1 kg de vapeur saturée à la température finale.
Soit la formule :
Titre de la vapeur
[modifier | modifier le wikicode]Le titre de la vapeur est la quantité de vapeur contenu dans le mélange eau-vapeur lors de la vaporisation.
Le titre, noté X, est compris entre 0 et 1 et ne possède pas d'unité.
Remarque: Le rapport se calcule pour un kg de mélange eau + vapeur et varie de 0 à 1.
- Pour X = 0, alors 0% de vapeur dans le mélange
- Pour X = 1, alors 100% de vapeur dans le mélange
1. Pour que X = 0, il faut que la masse de vapeur soit égale à 0. Ceci est valable jusqu'au moment où l'eau est à température d’ébullition sans bulle de vapeur.
2. Pour que X = 1, il faut que la masse d'eau soit égale à 0. Ceci est valable à partir du moment où la dernière goutte d'eau s'est transformée en vapeur ; on parle de vapeur saturée.
3. Quand le titre est compris entre 0 et 1, on parlera de vapeur saturée humide

Condensation
[modifier | modifier le wikicode]Rappel sur la condensation
[modifier | modifier le wikicode]La condensation dite liquide(appelée aussi liquéfaction), correspond au changement d'état d'un corps gazeux vers un corps liquide.
Elle est visible au quotidien ; les vitres de voiture, les verres de lunettes, les fenêtres embuées, les toiles d'araignées après que l'humidité de la nuit se soit condensée en gouttes d'eau sur les fils, l'air expulsé par nos poumons, composé de vapeur se condense et forme un peu de « brouillard » lorsqu'il fait froid.
Chaleur latente de condensation
[modifier | modifier le wikicode]La chaleur latente de condensation est la quantité de chaleur qu’il faut extraire à 1 kg de vapeur saturée (à pression et température constantes) pour obtenir 1 kg d'eau.
L'unité est le Joule/kilogramme (J/kg) et est notée : Lc
La chaleur latente de condensation est basée sur les mêmes principes que la chaleur latente de vaporisation. Sa seule différence est qu'elle cède de l'énergie pour passer de l'état gazeux à l'état liquide, contrairement à la chaleur latente de vaporisation qui demandait de l'énergie pour passer de l'état liquide à l'état gazeux.
Exemple d’utilisation de la chaleur latente
[modifier | modifier le wikicode]Un véhicule spatial en orbite basse qui souhaite revenir sur terre possède une énergie totale considérable:
- Il vole à environ 400 km d'altitude (énergie potentielle)
- Et a une vitesse de 25 000 à 30 000 km/h (énergie cinétique)
Pour atterrir à vitesse raisonnable, le véhicule doit se débarrasser de son énergie. Lorsque le véhicule spatial entame sa descente, il rencontre l'atmosphère. Les frottements exercés par l'air vont le réchauffer, transformant son énergie totale (cinétique et potentielle) en énergie thermique. Mais ce transfert d'énergie est tellement important, que les parois extérieures vont dangereusement chauffer et que des matériaux très spéciaux doivent être choisis pour le protéger de l'échauffement.
L'une des solutions retenue est l’utilisation de matériaux dits ablatifs dont la chaleur latente de changement de phase est importante:
- L'énergie thermique est principalement consommée par un changement de phase (en fait une sublimation)
- La protection thermique se consume au fur et à mesure de la rentrée atmosphérique



