Introduction à la mécanique quantique/Configuration électronique
Introduction
[modifier | modifier le wikicode]Il est facile de déterminer, pour un élément donné, combien d'électrons possède chaque atome. Par exemple :
- l'hydrogène H possède 1 électron ;
- l'hélium He en possède 2 ;
- l'ion H⁺ n'en possède aucun.
Sachant cela, la mécanique quantique permet de dire dans quelles orbitales on trouvera des électrons (les orbitales peuplées ou occupées) et dans quelles orbitales on n'en trouvera pas (les orbitales vacantes). Nous avons vu, assez tôt dans cette leçon, qu’il était possible de déplacer un électron d'une orbitale à une autre en excitant l'atome — c'est-à-dire en lui apportant de l'énergie. Nous avons également vu que cet état excité n'était pas permanent, et que l'énergie apportée était évacuée par l'atome sous forme de lumière (ce qui explique les raies d'émission). Ainsi, lorsque nous parlons d'orbitales occupées ou vacantes, il s'agit de l'état fondamental et non pas d'un état excité : c’est le cas le plus général.
La raison pour laquelle nous nous intéressons aux orbitales occupées ou vacantes est que cela détermine les propriétés physico-chimiques des éléments : leur réactivité, leur réaction en présence d'un champ magnétique… La position de chaque électron, dans l'état fondamental, pour un élément donné est appelée configuration électronique.
Quelques principes simples permettent de construire une configuration électronique a priori pour n’importe quel élément :
- le principe de l’Aufbau (que nous noterons a): les orbitales sont occupées par énergie croissante ;
- le principe d'exclusion de Pauli (p) : deux électrons ne peuvent se trouver dans un même état quantique (mêmes nombres quantiques et même spin) ;
- la règle de Hund (h) : si plusieurs orbitales ont la même énergie, les électrons se répartissent sur chacune d'elles avant de s'apparier.
Une couche électronique correspond à toutes les orbitales de nombre quantique n donné. Une sous-couche électronique correspond à toutes les orbitales de mêmes nombres quantiques n et l. Une case quantique correspond à une orbitale donnée, c'est-à-dire à l'orbitale de nombres quantiques n, l et m donnés.
On montre que, puisque chaque orbitale ne peut contenir que deux électrons (d'après p), chaque case quantique ne peut contenir que deux électrons. Donc, chaque sous couche peut contenir au maximum 4 × l + 2 électrons.
Nous introduisons maintenant deux moyens simples permettant de représenter la configuration électronique.
Notation textuelle
[modifier | modifier le wikicode]Une première façon, pratique, est la suivante :
- ntx
Avec :
- n le nombre quantique principal, correspondant à la couche ;
- t une lettre correspondant au nombre quantique l ;
- x le nombre d'électron dans la sous-couche n, l.
La lettre t correspond à la sous-couche :
- « s » lorsque l = 0 (cette sous-couche supporte 2 électrons) ;
- « p » lorsque l = 1 (cette sous-couche supporte 6 électrons) ;
- « d » lorsque l = 2 (cette sous-couche supporte 10 électrons) ;
- « f » lorsque l = 3 (cette sous-couche supporte 14 électrons) ;
- « g » lorsque l = 4 (cette sous-couche supporte 18 électrons) et par ordre alphabétique ensuite ;
Un exemple : l'hydrogène possède un seul électron, situé dans la première orbitale (n = 1, l = 0, m = 0). Sa configuration électronique est alors :
Un autre exemple : le lithium possède 3 électrons. Deux dans une première sous-couche (n,l,m = 1,0,0) et un dans une seconde sous-couche (n,l,m = 2,0,0). Sa configuration électronique est alors :
Un dernier exemple : le sodium possède 11 électrons, réparties sur 4 sous-couches.
Représentation des cases
[modifier | modifier le wikicode]On peut également, et cela est parfois plus intéressant, représenter les cases quantiques par de petits carrés. Les électrons, lorsqu’ils sont présents, sont représentés par une flèche vers le haut (spin up) ou vers le bas (spin down). On a ainsi quelque chose de la forme suivante :
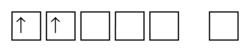
Les électrons :
- remplissent les cases de gauche à droite, correspondant à des énergies croissantes (d'après a) ;
- les électrons remplissent d’abord une sous-couche avant de s'apparier (d'après h) et portent un spin up lorsqu’ils sont célibataires ;
- il ne peut y avoir, dans une case, que deux électrons. Dans ce cas, ils ont un spin différent (d'après p).
On aura ainsi des configurations de la forme :


Mais pas de la forme suivante (car une case d'énergie haute est occupée alors que les cases d'énergie plus basse ne le sont pas, ce qui viole le principe a) :

Reprenons les exemples précédents :
Règle de Klechkowski[1]
[modifier | modifier le wikicode]- Wikipédia possède un article encyclopédique à ce sujet : « Règle de Klechkowski ».

Un moyen de prédire l’ordre dans lequel se placent les électrons, c'est-à-dire un moyen de suivre l'Aufbau, consiste à considérer que l'énergie d'une orbitale n, l, m est proportionnelle à n + l.
On appelle cette approche la règle de Klechkowski :
- « Les électrons occupent les orbitales libres par n + l croissant. Si deux orbitales ont même n + l, celle ayant le plus petit n est remplie en premier. »
Cela permet une prédiction a priori de l’ordre de remplissage, qui colle assez bien avec les données expérimentales pour les éléments des deux ou trois premières colonnes de la classification périodique.
Un moyen mnémotechnique permettant de se rappeler l’ordre de remplissage d’après cette règle est le diagramme de Klechkowski.
En particulier, d’après cette règle, les orbitales de nombres quantiques n et l donnés ont toutes la même énergie, quelle que soit la valeur de m : cela n’est pas toujours vrai, notamment en présence d'un champ magnétique (effet Zeeman).
Exceptions à la règle de Klechkowski
[modifier | modifier le wikicode]La règle citée précédemment n’est pas toujours pertinente. En effet, plusieurs effets viennent la faire mentir. Les principaux :
- la présence d'électrons dans une orbitale modifie son énergie — en particulier, une orbitale saturée est plus stable (énergie plus basse) que lorsque elle est vide ;
- les orbitales à partir de n = 3 ne respectent pas l’ordre n + l ;
- la présence d'un champ magnétique, comme évoqué précédemment.
Dans la pratique, nous retiendrons surtout les exceptions des premières lignes de la classification périodique qui sont des contre-exemples classiques :
- le chrome (période 4) : 1s2 2s2 2p6 3s2 3p6 3d5 4s1
- le cuivre (période 4) : 1s2 2s2 2p6 3s2 3p6 4s1 3d10
- l’argent (période 5): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10
On retiendra de ces exemples que la possibilité de saturer une orbitale prend parfois le dessus sur la règle, notamment pour les orbitales à partir de n = 3 ou 4.
Enfin, les gaz nobles (Néon, Argon, Krypton…) ne sont jamais des exceptions à la règle de Klechkowski. On peut ainsi les prendre comme références du point de vue de la configuration électronique. La configuration du cuivre, par exemple, pourra s'écrire :
- 1s2 2s2 2p6 3s2 3p6 4s1 3d10
aussi bien que :
- [Ar] 4s1 3d10
où « [Ar] » symbolise la configuration électronique de l'argon.
Électrons de valence et classification périodique
[modifier | modifier le wikicode]On appelle électrons de valence les électrons situés dans les couches qui suivent la structure d'un gaz noble. Par exemple, pour le cuivre ([Ar] 4s¹ 3d¹⁰), il s'agit des électrons 4s¹ 3d¹⁰.
La classification périodique des éléments peut s'expliquer par la nature des électrons de valence. On appelle couche de valence l’ensemble des électrons de valence. La classification périodique des éléments, attribuée à Mendeleïev, consiste à placer dans un tableau des éléments de comportement chimique similaire selon les colonnes, et de masses croissantes selon les lignes.
Prenons pour exemple la colonne de l'oxygène : O, S, Se, Te, Po. Observons la couche de valence de ces éléments :
- [O] : [He]
- [S] : [Ne]
- [Se] : [Ar]
- [Te] : [Kr]
- [Po] : [Xe]
On remarque la structure récurrente « s² p⁴ » caractéristique des éléments de cette colonne. Une représentation usuelle de leur couche de valence, due à Gilbert Newton Lewis[2] est utilisée dans l'essentiel de la chimie organique : les électrons de la couche de valence sont :
- célibataires, et représentés par un point ; ou bien
- appariés, représentés par une barre (on parle alors de « doublet »)
Pour l'oxygène, par exemple :

Tous les éléments de la même colonne seront représentés de la même manière, puisqu’ils partagent la même couche de valence (ou presque).
Liaisons chimiques dans la théorie de Lewis
[modifier | modifier le wikicode]Une approche simple de la chimie
[modifier | modifier le wikicode]Un avantage de la représentation introduite dans la section ci-dessus est de donner une représentation simple (à outrance) de ce que sont les liaisons chimiques. Nous étudierons ici le cas du dioxygène, mais il faut garder à l'esprit que cela n'est qu'une simplification du cas réel, lequel ne peut être abordé correctement qu'en termes d'orbitales atomiques. En particulier, dans la théorie de Lewis, on ne distingue pas la nature des liaisons chimiques, σ ou π notamment, alors que cela a une importance fondamentale en chimie quantique.
D'un autre côté, le fait que la théorie de Lewis soit dénuée de tout appareil mathématique ou physique en fait un moyen de choix pour aborder la chimie avec des boules et des bâtons. Elle n'explique cependant pas des faits expérimentaux simples et l’existence de nombreuses molécules : nous la décrivons ici car la notation est utile, mais la théorie de la liaison chimique ne nous servira pas.
Le cas du dioxygène
[modifier | modifier le wikicode]L'oxygène n’est pas observé en quantités appréciables comme atome seul (alors que c’est le cas pour l'hélium) : l'essentiel de l'atmosphère terrestre est constituée d'azote (sous forme de diazote N₂) et d'oxygène sous forme de dioxygène O₂.
La théorie de Lewis permet d'expliquer la formation du dioxygène : chaque atome d'oxygène porte deux doublets et deux électrons célibataires. Lorsqu’ils s'approchent, un électron libre de l'un et un électron libre de l'autre s'apparient pour former une liaison (ou « doublet liant »).

Il y a ainsi formation de deux liaisons, on parle de « double liaison », et on la représente par deux doublets entre les atomes :

Cette prédiction est bien vérifiée expérimentalement, notamment du fait qu'une double liaison est plus courte qu'une simple liaison, et on sait mesurer la longueur d'une liaison par des méthodes spectroscopiques.
Si ici on peut justifier l’existence du dioxygène, l'ozone O₃ constitue un premier cas pathogène pour la théorie de Lewis.
La théorie quantique nous permettra de retrouver ce résultat, de justifier l’existence de la double liaison, de l'ozone, et montrera même l’existence de deux types de dioxygène : l'oxygène triplet et l'oxygène singulet. La physique quantique, qui a changé notre façon d’aborder la mécanique, est depuis au cœur de la chimie.
Notes et références
[modifier | modifier le wikicode]- ↑ L'appellation « règle de Klechkowski » (avec plusieurs variantes concernant l’orthographe de ce nom) est semble-t-il propre à la France. Dans d'autres pays, on parle des règles de Klechkowski-Madelung, voire des règles de Madelungvoir ici. Parfois même, cette règle semble ne pas être (clairement) différenciée de l’Aufbauprinzip.
- ↑ G. N. Lewis, « The Atom and the Molecule », J. Am. Chem. Soc. 1916, 38, 762-785. DOI 10.1021/ja02261a002.



![{\displaystyle \left[\mathrm {H} \right]=1s^{1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0f5afd7370220116a7ff50e853f1a50bf3000d68)
![{\displaystyle \left[\mathrm {Li} \right]=1s^{2}\;2s^{1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4030496aa1cf69db7ca3480aa87f03d95fa6aa90)
![{\displaystyle \left[\mathrm {Na} \right]=1s^{2}\;2s^{2}\;2p^{6}\;3s^{1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f3a601b6756fe301417d48ec14e486ab12a75fc8)
![{\displaystyle \left[\mathrm {H} \right]=\underbrace {\left[\uparrow \;\right]} _{1s^{1}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/563edd26948c5564e816969c035dd7d29db2e01f)
![{\displaystyle \left[\mathrm {He} \right]=\underbrace {\left[\uparrow \downarrow \right]} _{1s^{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/14546a6f32b66106a104ae45081cd68094484a33)
![{\displaystyle \left[\mathrm {Li} \right]=\underbrace {\left[\uparrow \downarrow \right]} _{1s^{2}}\;\underbrace {\left[\uparrow \;\right]} _{2s^{1}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6a895b42dc1f4ea9c28db18442b6e56208e26379)
![{\displaystyle \left[\mathrm {Na} \right]=\underbrace {\left[\uparrow \downarrow \right]} _{1s^{2}}\;\underbrace {\left[\uparrow \downarrow \right]} _{2s^{2}}\underbrace {\left[\uparrow \downarrow \right]\left[\uparrow \downarrow \right]\left[\uparrow \downarrow \right]} _{2p^{6}}\;\underbrace {\left[\uparrow \;\right]} _{3s^{1}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fdf5b16d94c8b1bf8014f3257ed05865346e4b70)




