Hybridation moléculaire/Hybridation moléculaire sp³ du Carbone
Avant-Propos
[modifier | modifier le wikicode]Envisageons le cas du méthane, qui est une des molécules organiques les plus simples. Le méthane, de formule
CH4
, est donc composé d'un atome de carbone lié à quatre atomes d'hydrogène. Chaque liaison C-H forme avec les 3 autres un angle de 109°28', les 4 atomes d'hydrogène étant équidistants entre eux et équidistants du carbone. C'est une structure tétraédrique.
Sur base de la structure électronique de l'atome de carbone 1s22s22p2, il n’est pas évident de comprendre:
- pourquoi le carbone est tétravalent
- pourquoi le méthane est une molécule tétraédrique
Tétravalence du carbone: explication
[modifier | modifier le wikicode]Configuration électronique du carbone:
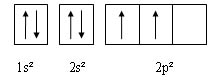
Sous cette forme, il y a un problème. En effet, deux liaisons C-H vont être réalisables via les électrons célibataires des orbitales 2p. Mais deux Hydrogènes ne pourront pas faire de liaisons avec le C, faute d'électron de valence.
Imaginons que l’on amène un électron de l'orbitale 2s vers l'orbitale 2p non occupée. On peut alors envisage que les quatre orbitales atomiques simplement occupées ainsi obtenues (1 orbitale 2s, 3 orbitales 2p) peuvent permettre de réaliser des liaisons avec les orbitales 1s des atomes d'hydrogène. On obtient ainsi 4 liaisons C-H, le carbone est devenu tétravalent.

Origine de la géométrie tétraédrique du méthane: le Carbone tétragonal
[modifier | modifier le wikicode]
Par contre, sur base de la géométrie des 4 orbitales simplement occupées du carbone tétravalent, on ne peut pas expliquer la structure tétraédrique du méthane. En effet, 4 liaisons sont possibles, dont trois se font via les orbitales 2p orientées selon l'axe x, y ou z. Mais il subsiste une liaison, via l'orbitale 2s, sans orientation précise (puisque c’est une sphère.
L'existence de 4 liaisons identiques, disposées selon le modèle tétraédrique, s'explique en admettant que les orbitales 2s et 2p du carbone ne restent pas identiques mais se mélangent. Il résulte de cette hybridation (mélange d'entités de caractères différents) quatre orbitale identiques, nommées orbitales hybridées sp³. Par définition, une orbitale sp3 résulte de la combinaison linéaire (somme) des orbitales s et p.
° sp3 signifie "hybridation de 1 orbitale s et de 3 orbitales p", d'où l'indice 3 au dessus du p (l'indice 1 au dessus du s est sous entendu)
° On obtient bien 4 orbitales hybridées car l'hybridation de X orbitales atomiques mène à X orbitales hybrides.
Image orbitale sp³ à ajouter (viendra bientôt)
Il existe donc, pour le carbone tétravalent dans notre cas, quatre orbitales sp3 possédant chacune un électron célibataire. Afin de minimiser la répulsion électronique entre eux, les orbitales vont s'arrange dans l'espace avec une symétrie tétraédrique qui va maximiser les distances entre elles et minimiser la répulsion électronique.
Ensuite, c’est simple: quatre atomes d'hydrogène (chacun amenant avec lui un électron libre) vont se lier via des liaisons σ avec les quatre orbitales sp3 du Carbone, ce qui mène à la formation du méthane.



