Transformations thermodynamiques/Transformations
On dit qu'un système thermodynamique subit une transformation lorsqu’il passe d'un état d'équilibre initial à un état d'équilibre final.
Types de transformations[modifier | modifier le wikicode]
Un système isolé qui n’évolue pas est dans un état d’équilibre. Un système non isolé qui n’évolue pas peut se trouver dans deux situations :
- il peut être en équilibre avec l’extérieur (les flux avec l’extérieur sont nuls) ou
- il peut être dans un état stationnaire ou régime permanent ( les flux sortants sont égaux aux flux entrants).
La transformation d’un système qui passe de l’état initial A vers un état final B en passant par une suite infiniment proches d’état d’équilibre est dite réversible. Les transformations constituées par une succession continue d’états d’équilibre sont aussi appelées transformations quasistatiques. Dans le cas contraire, la transformation est dite irréversible.
- Transformation infinitésimale : Une transformation est infinitésimale lorsque les états d'équilibre initial et final sont infiniment proches.
- Transformation quasistatique : Une transformation est quasistatique ou infiniment lente si elle amène le système de l'état initial à l'état final par une succession d'équilibres très proches.
- Transformation réversible : Une transformation réversible est une transformation quasistatique renversable, c'est-à-dire que l’on passe par les mêmes états d'équilibre pour aller de l'état initial à l'état final et vice-versa. Dans un processus quasi-statique renversable, il n'y a pas de création d'entropie S. Il n’est pas possible de réaliser un processus quasi-statique ou un processus réversible, on peut seulement approcher ces modèles afin de minimiser la création d'entropie. Dans la réalité, toutes les transformations sont irréversibles.
Relations du système avec l'extérieur[modifier | modifier le wikicode]
- Transformation adiabatique : Une transformation est dite adiabatique lorsqu'au cours de la transformation, le système n'échange pas de chaleur Q avec le milieu extérieur.
- Transformation diathermane : Une transformation est dite diathermane lorsqu'au cours de la transformation, le système échange de la chaleur Q avec le milieu extérieur.
- Transformation monotherme : Le système est en relation avec un seul réservoir de température.
Transformations où un paramètre reste constant[modifier | modifier le wikicode]
Les transformations entre deux états se font souvent en laissant un ou plusieurs paramètres constants. On donne alors des noms différents suivant le paramètre qui reste constant =
- Transformation isotherme : Une transformation est dite isotherme lorsqu'elle se déroule à température constante ( T = cte ).
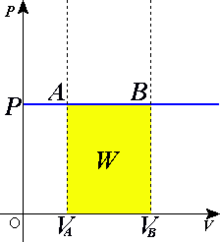
- Transformation isobare : Une transformation est dite isobare lorsqu'elle se déroule à pression constante ( P = cte ).
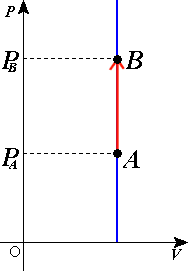
- Transformation isochore : Une transformation est dite isochore lorsqu'elle se déroule à volume constant ( V = cte ).
 |
 |
 |
Transformations dithermes cycliques[modifier | modifier le wikicode]
Ces transformations se font sur un cycle dans un système isolé qui comprend deux sources de chaleur à températures constantes et un réservoir de travail. Ces transformations dithermes cycliques sont utilisées dans les machines thermodynamique (moteur, réfrigérateur, pompe à chaleur).

Transformations chimiques[modifier | modifier le wikicode]
Le système peut voir sa composition évoluer soit:
- parce qu’il y a des réactions chimiques entre les espèces dans le système;
- parce que c’est un système ouvert qui peut échanger des molécules aux parois avec l'extérieur;
- dans le cas d'un réacteur, on aura les deux phénomènes qui interviennent en même temps.


